動物プリオン病の病態-特に牛海綿状脳症(BSE)を中心に-
プリオン病は伝達性海綿状脳症ともよばれ,動物プリオン病と人プリオン病に大別される.プリオン蛋白自体は元々人をはじめ牛などの体内に存在しているもので,正常なものはそれ自体病原性を有しないが,ひとたび異常型プリオン(PrPSc, PrPBSE, PrPCJD)が体内に入り込むと正常型(PrPC)のものを次々と異常型に変えていくとされている.PrPCはタンパク質分解酵素処理に感受性を示すのに対して,PrPScは部分的に抵抗性を示す.また,構造にも違いがみられ,PrPCはαへリックス含量が高く,βシート構造をほとんど含まないのに対して,PrPScではβシート構造含量が著しく増加する.つまり,PrPCからPrPScへの変化はαへリックスからβシート構造への変換によると推察されている.
1985年英国で新たな牛の疾患が見いだされ,1986年に牛海綿状脳症(BSE)と命名され,報告された.その後,マウスへの伝達性が証明されたことから伝達性海綿状脳症の1つであることが確認された.BSEはその後急速に英国内に拡がりをみせた.1988年には肉骨粉による伝搬が疑われたことから,反芻動物由来タンパク質を反芻動物用の餌にすることが禁止された(Feed ban).1990年には脳や脊髄といった特定臓器を餌にすることが禁止され,さらには1996年にすべての家畜への肉骨粉の使用が禁止された.また,1996年にはBSEの人への感染とされる新型CJD(vCJD)の発生が報告されている.
2001年本邦におけるBSEの発生を受け,と畜場に搬入される全頭についてBSE検査が実施されている(図1).この検査は,ELISAを使ったスクリーニング検査とELISA検査陽性牛に対するウエスタンブロット(WB)法(図2:感染研山河博士提供)と組織学的(図3)および免疫組織化学的方法(図4)(図3と4は感染研佐多博士提供)による確認検査からなる. WB法が蛋白の電気的な篩い分けによる解析・診断法であるのに対して,後二者は病理学的検査であり,神経組織におこっている変化や正常型プリオン蛋白(PrPC)が変化した異常型プリオン蛋白(PrPSc)がどのように蓄積しているかといった局在や蓄積パターンを形態学的に調べる診断手法である.この方法を用いたと畜場搬入牛および斃死牛のサーベイランスにより本邦では36頭のBSEが確認されているが、2009年1月を最後に発生は確認されていない(2011年4月現在).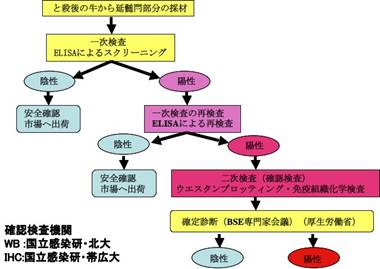
図1
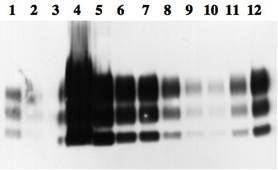 図2 図2
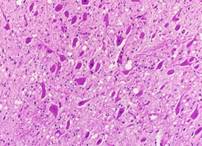 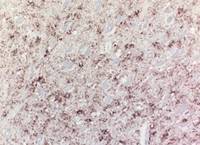
図3 図4
スクリーニング検査,確認検査では延髄,特に閂(かんぬき)と呼ばれる部分よりサンプリングを行う(図5).延髄は人を含め動物にとって非常に重要な部位で,運動や知覚を支配する神経核(神経細胞の集塊)や体中に張り巡らされた神経線維が経由する神経核が多数みられる(図6).
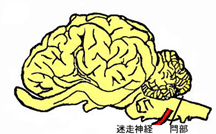 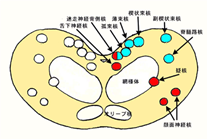
図5 図6
BSEではこの延髄部分に病変が必発で,PrPScの蓄積が多くみられることがこの部位をサンプリングする理由であるが,臨床症状を伴わないBSEではこの部分全般に病変がみられるわけではない.BSEの初期,つまり健康畜として搬入されBSEとして摘発されたような牛では極めて限定した神経核(迷走神経背側核,孤束核等)に重篤な病変が局在する.では何故この部分に病変が強くみられるのだろうか.図5の閂部分近くより出ている迷走神経は図7で示すように,消化管に分布する.これまでの羊のプリオン病であるスクレイピーでの知見や実験動物での感染試験の知見より,消化管に取り込まれたPrPScはこの迷走神経神経線維に沿って中枢神経系に伝達されると考えられている.こういった病変の特徴や感染経路は羊スクレイピーや北米大陸のヘラジカ,ムールジカに拡がっているプリオン病の一つである慢性消耗性疾患(CWD)と同様である.現在までのところヒトのプリオン病の多数を占める遺伝性,あるいはsporadicといった中枢神経系を原発とする病型は動物には確認されていない(2003年頃から欧米,日本で報告のある非定型BSEについてはその可能性が議論されている).
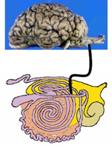 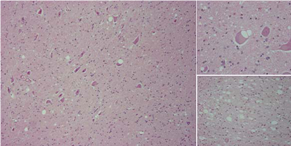
図7 図8
臨床症状を示すBSEの病理組織所見として一般的に知られている変化は神経細胞体や神経網の空胞形成であり(図8),免疫組織化学的には,小斑状や線状の陽性所見を示し,神経細胞体やその突起,あるいは神経網の空胞を縁取るようにみられる(図9).
免疫組織化学的所見を含めた病変の分布は延髄を中心として脳幹,視床が重度で,中脳では赤核,三叉神経中脳路核,橋,延髄では前庭神経核,孤束核,三叉神経脊髄路核,網様体を中心にみられる(図10).
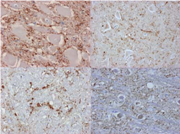 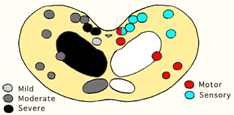
図9 図10
一方,全頭検査で摘発された6頭(本邦第2から7例目)(それぞれ猿払,群馬,音別,神奈川,和歌山,北見例)はいずれもBSE固有の臨床症状を示さない準臨床的BSEであった.半数の3頭ではいずれも組織学的に迷走神経背側核にわずかな空胞形成とミクログリアの活性化を認めたが,組織学的にはBSEの診断には至らなかった.免疫組織化学的には迷走神経背側核,孤束核,顔面神経核などに限定していた(猿払例;図11).残りの3頭では迷走神経背側核,孤束核,オリーブ核,網様体辺縁部,稀に神経細胞体にも空胞形成がみられ,組織学的にもBSEが疑われた.免疫組織化学的には,組織学的所見の得られた部位に加え,疑核,顔面神経核,三叉神経脊髄路核等に陽性所見がみられた(群馬例;図12).このような病変分布の検索からBSEでは,迷走神経背側核に最初にPrPScの蓄積がみられ,経過とともに知覚核を中心に蓄積する範囲が拡大する傾向にあることが分かる.さらに,運動核の陽性所見は全頭検査で摘発されたBSEではほとんどみられないか,あっても極めて軽度であるのに対して,臨床症状のみられるBSE症例では舌下神経核,顔面神経核といった運動核に強い陽性所見が観察される.このような脳内のPrPScの拡がり方は,BSEの初期にみられる音・光・接触等に対する神経過敏を説明するかもしれない.
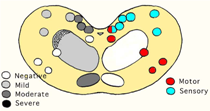 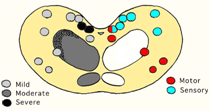
図11 図12
BSEの由来になった海綿状という言葉は,神経網にみられる空胞形成に由来するが,なぜ空胞ができるのだろうか.一般的にはPrPScの蓄積程度に従い,空胞の形成が顕著になることからPrPScがtoxicに働き,組織に傷害を与えているという説が有力なようであるが,脳の組織構成成分であるアストログリアやミクログリアの関与説を含めまだ確定していない.
表1は自家検索例に基づくBSEとスクレイピーのPrPScの蓄積部位について示した.中枢神経系における病態やPrPScの蓄積部位にはほとんど違いはない.特徴的なのはリンパ系組織における分布の違いで,BSEでは脾臓,口蓋扁桃,体幹部や消化管リンパ節といったスクレイピーに陽性がみられる部位がいずれも陰性となる.このような違いが,動物種によるものなのか,あるいはいわゆる“株”といったものに規定されるのかはいまのところはっきりしていないのが現状である.ただ,こういった違いがBSEの生前診断を難しくし,また,いったん消化管に入ったPrPScの神経系への伝達機構の解明を複雑にしている.
図13はアミロイド斑を示す.プリオン染色陽性の細線維からなる斑状の特徴的な構造で,BSEやスクレイピーに稀に見いだされる所見である.また,新型CJDでは特徴的な所見とされている.このアミロイド斑の周囲には空胞が取り巻くようにみられ,その形から’florid plaque’とも呼ばれている.この構造はコンゴーレッド染色に陽性を示し,また,抗プリオン抗体に対しても強い陽性を示す.このアミロイド斑の意義やその形成機序についてもよく分かっていない.
病理屋の一私見として,海綿状の空胞形成やこういったアミロイド斑周囲の空胞は脳にたまったプリオンを生体側の反応として脳組織から隔離するといった分界という現象としてとらえることはできないのかと考えている.前述したようにその役割や機構についてはまだまだよく分かっていないが,ミクログリアやアストログリアがそのことには大いに関与しているはずである(図14:上はアミロイド斑に対するアストログリアの反応,下はミクログリアの反応).
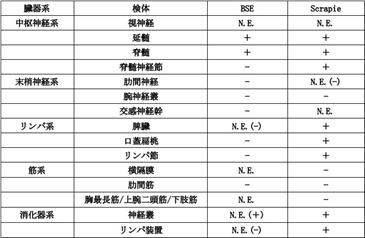
表1 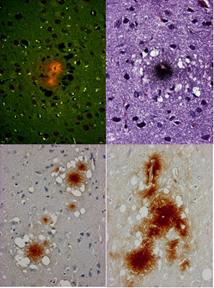 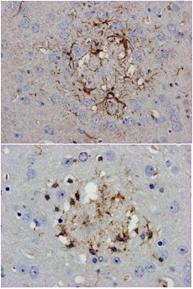
図13 図14
共同研究者
感染研:山河芳夫先生,佐多徹太郎先生
北海道大学:堀内基広先生
前動衛研プリオン病研究センター長:品川森一先生
1番上へ戻る |


