| ホルスタイン牛の遺伝性横隔膜筋症の病態 |
1970年代前半から1980年代前半にかけてオランダの東部で飼育されているMeuse-Rhine-Yssel(MRY)種に,横隔膜筋部に主病変を有し,遺伝性が示唆される横隔膜筋ジストロフィー症が報告されている.発症年齢は2〜10歳(平均5歳),60頭以上の牛に発生が確認されている.この疾患では再発性あるいは慢性鼓脹症がみられ,その原因となる横隔膜筋部は肉眼的に褪色し,腫脹,やや硬結感を有する.また,病理組織学的には筋繊維の大小不同,空胞化,肥大繊維の分裂(fiber splitting),核の中央移動,線維化などとともに,筋繊維の中央もしくは辺縁部における大小のコア様構造の出現を特徴とし,同様の構造物は心筋にも出現することが報告されている.
ホルスタイン種については,食肉検査員中村直子により1990年頃にと畜場で褪色した横隔膜が見いだされた.その特徴的な病理組織像はMRY種で報告のある横隔膜筋ジストロフィー症のそれに極めて類似していた.その後,2例の慢性鼓脹症を示す臨床例の剖検材料も得られたことから,と畜場例と剖検例を併せて,1994年にホルスタイン牛の横隔膜筋ジストロフィー症としてNakamuraらにより報告された(参考文献1).
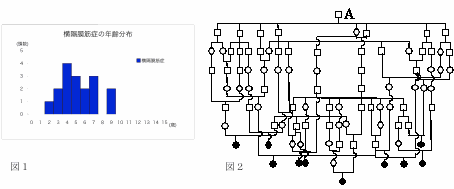
前述した2例の剖検例を嚆矢とし,慢性鼓脹症の剖検を行う機会が相次ぎ,と畜場症例の7例を含む17例が集積され,これらについて遺伝学的背景,病理形態学的詳細について検索を実施した.発症年齢はMRY種と同様に2から9歳とその分布に広がりはみられるものの,比較的高い年齢の牛に発症がみられる傾向にあった(図1).登録証をもとに1頭ずつの系図を作成し,それを重ね合わせたところ,1頭のFounderと推測される種牛Aを頂点とする常染色体劣性の遺伝様式を示唆する発症牛の系統図が得られた(図2).
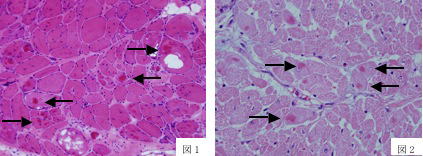
病変の主体は横隔膜筋にみられるものの,軽度ではあるが同質の変化が内および外肋間筋,症例によっては腹鋸筋,上腕二頭筋,大腿四頭筋にもみられている.図3には横隔膜,図4には心筋の病変を示す(矢印は特徴的なコア様構造).中間径フィラメントを含む筋構造蛋白に関して免疫組織化学的検索を行ったところ,このコア様構造はアクチンに強陽性を示した.また,電子顕微鏡的には細い筋フィラメントに連続するフィラメントの凝集からなっていた(参考文献2-4).
ヒトの神経変性疾患,ハンチントン病などのポリグルタミン病での核内封入体,パーキンソン病でのLewy小体,あるいはアルツハイマー病での神経原線維変化ではユビキチンやプロテアソームが高度に蓄積し,タンパク質のユビキチン化とそれに引き続く分解系の不全が発症に密接に関係して
いると考えられている.筋疾患に関してはこのような報告はなされていないが,コア様構造をこれら神経変性疾患にみられる封入体と同質の変化と捉えた場合,これらコア様構造のユビキチン化が期待され,実際免疫組織化学的にも確認することができた.つまりコア様構造はアクチンフィラメントを主体とした変性筋タンパクの凝集とユビキチン化からなっていた.
このような病理学的な解析と平行して,原因遺伝子探索のために家畜改良センター杉本(小松)真由美らとの共同研究が開始され,その結果2003年にHSP70のアイソファームの一つであるHSPA1Bが原因遺伝子であり,その完全欠損が本症を引きおこすことが明らかとなった.欠損遺伝子であるHSPA1BはHSPA1Aとの重複遺伝子であり,いずれも641個のアミノ酸をコードする.両者はアミノ酸レベルで一個の違いからなるため,現在まで両者を区別するための特異抗体は得られていない(参考文献5).
遺伝子診断が可能になったことから,家畜改良事業団との共同研究により本症の浸潤状況調査を実施した.十勝管内5農場で477頭について実施したところ,保因牛41頭,欠損牛3頭が摘発できた.さらに実施した718頭の検索では6頭の欠損牛と111頭の保因牛が見つかっている.この遺伝子診断により摘発された欠損牛のうち,分娩後の子宮炎により廃用となった牛(6歳)の横隔膜筋組織には大小不同,空胞変性といった変化はみられなかったが,特徴的なコア様構造の形成が確認された.このことからコア様構造形成が初期の病態であり,本症原因蛋白の機能解明はコア様構造形成のカスケードや,疾患発症にいたるメカニズムの解明に重要であると考えられた.
一般的に,HSP70は,蛋白の折り畳みや変性タンパク質の再生,あるいはユビキチンプロテアソーム系を活性化させることで変性タンパク質の分解を促す機序が知られている.このことからいくつか簡単なシナリオが推察される.筋収縮や伸展に伴う筋タンパクの変性・凝集はHSPA1B欠損により再生機構が機能しないため蓄積,あるいはユビキチンプロテアソーム系の活性化が抑制された結果分解不全となりコア様構造が形成される.あるいは,HSPA1Bの欠損はタンパク質自体のコンフォメーション変化,つまり違う三次元構造に間違って折り畳まれることで正常な機能を失い,ユビキチンプロテアソーム系による分解亢進,その分解断片の蓄積としてコア様構造が出現する.
原因遺伝子は解明されたものの,そのタンパク質の局在を含む役割は不明である.また,発症年齢にも幅があることから,発症には他の要因も深く関わっているものと思われる.
参考文献
- Muscular dystrophy of the diaphragmatic muscles in Holstein-Friesian cows. Nakamura N, Doi T, Furuoka H, Katoh M, Inada I, Iguchi H, Osame S, Matsui T. J Vet Med Sci. 1994 Oct;56(5):993-994.
- Hereditary myopathy of the diaphragmatic muscles in Holstein-Friesian cattle.
Furuoka H, Doi T, Nakamura N, Inada I, Osame S, Matsui T. Acta Neuropathol.
1995;90(4):339-346.
- Immunohistochemical study of some cytoskeletal proteins in hereditary myopathy
of the diaphragmatic muscles in Holstein-Friesian cattle. Furuoka H, Murakami
A, Tsuchihashi M, Yokota H, Doi T, Kobayashi Y, Matsui T, Horiuchi M, Taniyama
H. Acta Neuropathol. 1999 Feb;97(2):177-184.
- Immunohistochemical and electron microscopical studies of myocardial inclusions
in hereditary myopathy of the diaphragmatic muscles in Holstein-Friesian
cattle. Furuoka H, Murakami A, Doi T, Kobayashi Y, Matsui T, Nakamura N.
Acta Neuropathol. 1999 Feb;97(2):185-191.
- Deletion of one of the duplicated Hsp70 genes causes hereditary myopathy
of diaphragmatic muscles in Holstein-Friesian cattle. Sugimoto M, Furuoka
H, Sugimoto Y. Anim Genet. 2003 Jun;34(3):191-197.
1番上へ戻る
|
|
|


