�������w
![]()
�ߋ���
�ȉ��̍\���������Ȃ����B�܂��������Ȃ����B
�oA�p�Q
1. ���|D�|�O���R�[�X��Haworth�̊�
2.D�|�K���N�g�[�X��Fischer�̓��e��
3.��-D-�t���N�g�V��-(2-1)-��-D�O���R�s���m�V�h
4.18:1n-9
5.�V�g�X�e���[��
6.�X�t�B���S�~�G����
7.20:4��8,11,14�17�@8.�O���V��
9.�A�X�p���M��
10.���V��
11.�V�X�e�C��
12. D�|���{�[�X
13.�v�����ƃs���~�W��
�oB�p�Q
1�D���|D�|�K���N�g�[�X��Haworth�̊@2. D�|�}���m�[�X��Fischer�̓��e��
3.�}���g�[�X4.18:3n-3
5.�R���X�e���[��
6.�g���A�V���O���Z���[��
7.22:6��4,7,10,13,16,19 8.�g���I�j��
9.�t�F�j���A���j��
10.�o����
11.�O���^�~��
12. DNA�̈ꎟ�\�� 13.RNA�̈ꎟ�\��
�oC�p�Q
1.D�|�O���R�[�X��Fischer�̓��e��
2.���|D�|�K���N�g�[�X��Haworth�̊� 3.�V���� 4.18:2n-6 5.�R���X�e���[���G�X�e��
6.�z�X�t�@�`�W���R����
7.20:4��5,8,11,14 8.���`�I�j��
9.�g���v�g�t�@��
10.�A���M�j��
11.�v������
12.DNA�̈ꎟ�\��
13.RNA�̈ꎟ�\��
�oD�p�Q �P�D���|D�|�}���m�[�X��Haworth�̊�
2.D�|�O���R�[�X��Fischer�̓��e��
3.����
4.18:3n-6 5.�V�g�X�e���[��
6.�z�X�t�@�`�W���G�^�m�[���A�~��
7.20:5��5,8,11,14�17 8.�Z����
9.�`���V�� 10.���C�V��
11.�q�X�`�W�� 12. �Q�|�f�I�L�V�|D�|���{�[�X 13.�v�����ƃs���~�W��
�@�@�������w�@���e�X�g�Q�|�P�\���������ȒP�ɐ�������B
�P�DNAD�ACoA�A�A�~�m���A���������A�P�g�[�X
�Q�DGTP�A�J���j�`���A�A���h�[�X�A�g���A�V���O���Z���[���A������
�R�DFAD�A�A�~���[�X�AACP�A�s���m�[�X�^�A20:45,8,11,14 �S�DATP�A�r�I�`���A�E�����_�A�Z�����[�X�A�s�����b�_
�@�@�������w�{�����@2001�N7��15���@
A.�����̐��̓��G�l���M�[�Ƃ��ďd�v��ATP�́A�i1�j����x���̃����_���i2�j�_���I�����_���i3�j�������_���@�ɂ���č��������B�i1�j�Ɓi2�j�ł�ATP�����ɂ��Ĉȉ��̌��̒�����K�v�Ȍ��t��I�яo���Ďg����������B����偄�`���R�C�h���A���C�I�A�d�q�A�d�q�`�B�n�A�G�l���M�[���x���AADP�AGTP�A�O���R�[�Q���A�s���r���_�A�A�Z�`��CoA�ANAD+�A�v���X�g�L�m���AFAD�A�~�g�R���h���A�����A���G�l���M�[�A�t�ΆA�C�\�N�G���_�A�z�X�z�G�m�[���s���r���_�A2-�I�L�\�O���^���_�A�R�n�N�_�A1,3�|�r�X�z�X�z�O���Z�����_�A�����S�_�A�V�g�N�������A�זE���A�v���g��ATP�A�[�[�A�t�F���h�L�V��
B.���b�_�̃��_���ɂ��āA�ȉ��̌���p���Đ�������B�܂��A�p���~�`���_�����_�������Ƃ�������ATP�ʂ��A���R�������ē����Ȃ����B����偄�A�V��CoA�A�V���g�����X�t�F���[�[�A�G�m�C��CoA�q�h���^�[�[�A�f�q�h���Q�i�[�[�A3-�q�h���L�V�A�V��CoA�f�q�h���Q�i�[�[�AFAD�ANAD+�ACoA�AATP
C.�A�~�m�_�̎����Ă��鉻�w�I�����́A�����C�I���ł��邱�ƁB���̂��߂ɃA�~�m�_�̎����d�ׂ́ApH�ɂ���ĕω�����B�_���A�~�m�_�ł���A�A�X�p���M���_���Ƃ��āA�����d�ׂƓd���ɂ��č\�����̕ω������pK1=2�ApI=4�ApK2=9.5��p���Đ�������B
D. ���j�����Ɛ^�j�����̈�`���̔����ƒ��߂ɂ͂������̈Ⴂ��������B�i�P�j���j�Ɛ^�j�����̓]�ʋ@�\�̈Ⴂ�������A�i�Q�j�^�j������mRNA�̍\����̓�����}�����āA�����̌��FRNA�|�������[�[�A�G�L�\���AGTP�A���`�����A�|��A�A�X�v���C�V���O�A�C���g�����@��p���Đ�������B
E. �������w�̎��Ƃ���u���ċ��������������Ƃ͉��ł��傤���H�܂��A���Ƃ̓_����100�_��ŏ����Ă��������B
�@�@�������w�����P2002�N1��23��
1. �h�{���i�����A�����A�^���p�N���j�́A���̃G�l���M�[�iATP�j�ɕϊ����ꗘ�p����Ă���B���̑�ӌo�H�̊T�v��}�����Ď����AATP�̐����ߒ��ɂ��Đ�������B���̍ہA��ӏ�ŏd�v�ȃ|�C���g�ƂȂ鉻�����̍\����}���ɋL�����Ȃ����B�i50�_�j
2. �^�j�����́iA�j��`�q�̕����A�iB�j��`�q�̓]�ʂƖ|��ɂ��Đ�������B�i50�_�j
3. �ȉ��̌����������B�i50�_�j�P�D�A�m�}�[�@2�D�w�~�A�Z�^�[���@3�D���{�]�[���@�S�D�J���j�`���@�T�DNAD�@�U�DFAD�@�V�D�Z���g�����h�O�}�@�W�D�G�L�\���ƃC���g�����@�X�D�K�{���b�_�@10.�@�K�{�A�~�m�_
4. �������������Ă��鐶�����w�Ɋ֘A������e���P�����A���R���������B�i5�_�j
5 �^���p�N���̈ꎟ�\������@���A�ȉ��̏��ɏ]���@�����A�A�~�m�_�g���B���q�ʌ���C�y�v�`�h�f�Ђւ̕����D�G�h�}�������E�S�A�~�m�_�z��̌���ɂ��Đ�������B
![]()
�ۑ背�|�[�g�P
�P�D��v�ȍזE���I���K�l���̊e�@�\�ɊT�v���������B
�@<�����A�A���ɋ��ʂȂ���>
�j�c�j�̎�Ȑ����@�\�͂q�m�`�̍������w�����邱�Ƃł���B�Î~��Ԃ̍זE�ł́A����Ԃł���A�זE���ێ����邽�߂̍ŏ����̂c�m�`�Ƃq�m�`�̍������N���邾���ł���B�����������r���̍זE�̊j�ł͊����ɑ�ӂ��s���Ă���B�j���ɂ͂���Ɋj���̂ƌĂ����̂�����A����̓��{�\�[���q�m�`�C���{�\�[������������B
�זE����c�זE���튯�̊Ԃ߂Ă���S���̂���t��̕����ŁA���̒��Ɋe��̃^���p�N�������ׂȔ��ׂȑ@�ۍ\��������Ă���B��ӂ̉n���s����̂����̍זE����ł���B�n�ł̓O���R�[�X���Q���q�̃s���r���_�ɕ������Ă���B���̉ߒ��łQ���q��ATP����������B
�~�g�R���h���A�c�ᕪ�q�������_�����čזE���`�s�o�̂قƂ�ǂY����B�O���R�[�X�������Ƃ����ꍇ�A�זE����ō��ꂽ�s���r���_����܂��}�g���N�X�ŃA�Z�`��CoA�Ɉى�����Ă���N�G���_��H�ɓ���QATP�����������B�����ăN���X�e�ʼnn�ƃN�G���_��H�Ŕ�������NADH2��FADH2�������Ƃ���34ATP�����������d�q�`�B�n�̔������N����B�������ă~�g�R���h���A���ō��v36ATP�����������B�܂��~�g�R���h���A�ɂ͓Ǝ���DNA���L��A�~�g�R���h���A�����B����Ƃ��̓~�g�R���h���A���番�đ��B����B�����ŋN���锽�����n�̔����ƈꏏ�ɉ��w�������ɂ���ƁAC6H12O6�{6H2O�{6O2��6CO2�{12H2O�{38ATP�ƂȂ�B
���E�́c���{�\�[���ɕt�����Ă�����̂ƁA���Ă��Ȃ����̂Ƃ�����B���{�\�[���ɕt�����Ă�����̂́A���{�\�[���ō������ꂽ�^���p�N������荞�݁A�S���W�̂֗A������B�܂����{�\�[���ɕt�����Ă��Ȃ����̂́A�זE���ɐN������L�Q�������_�����Ė��Q�Ȃ��̂ɂ��铭��������B
���{�\�[���c�j���ɂ���DNA�̈�`���ɂ��ƂÂ��ă^���p�N���̍������s���Ă���B���E�̂ɕt�����Ă�����̂ƁA���Ă��Ȃ����̂Ƃ�����A��҂͍זE������Ƀ^���p�N������������B
�S���W�́c���̏W���̂ŕ���^���p�N���Ȃǂ��܂��E�����A�����̒����E�Z�k�E����E�A�����s���튯�ł���B�܂��A���{�\�[���̌`���ɂ��֗^���Ă���B
�y���I�L�V�\�[���c�ߎ_�����f������y�f�i�J�^���[�[�j��A�_���_������y�f�����B�q�g�ł͌����邪�A�_��r�����Ƃ��钹�ނ���ނł͔A�_���_������y�f�Q�������Ȃ��B
�זE���c���������̂Q���q�̑w�̒��Ƀ^���p�N�������U�C�N��ɂ͂ߍ��܂�Ă���ƍl�����Ă���B�זE���͔������ł���A�n�}�͒ʂ����n���͒ʂ��Ȃ��B�������A�זE���ɂ͑I�ߐ�������A�J���V�E���|���v��i�g���E���|���v�Ȃǂ̔\���A���ƁA�A�~�m�_�ⓜ��A������A���Ƃ�����A�\���A���̓G�l���M�[���g�����A���͎g�p���Ȃ��@�@�@
<�����זE�ɓ��L�Ȃ���>
���\�\�[���c�^���p�N���A�j�_�A�����Ȃǂ��זE���������鏬�E�ŁA�H��p�̌��ʐ�����t�@�S�\�[���ƗZ������Ɗ܂܂�Ă������������y�f�������������B
���S�́c�X�{�̎O�g�����ǂ���o���Ă���A�זE���ɖa���̂ƂȂ���F�̕��ɏd�v�Ȗ������ʂ����B
�@<�A���זE�ɓ��L�̂���>
�t�Άc��̃`���R�C�h�Ƃ���ȊO�̃X�g���}����Ȃ�A�A���זE���Ō��������s���B�`���R�C�h�ɂ͓����F�f��������G�l���M�[���z�����Đ����N���A���f�C�I���Ǝ_�f�ɕ�����B�X�g���}�ł́A�`���R�C�h�Ŕ����������f�C�I���𗘗p���āA�Y�_�������s���A�O���R�[�X�����o���B�����ŋN���锽�������w���ɂ���ƁA6CO2�{12H2O�{���G�l���M�[��C6H12O6�{6H2O�{6O2�@�@�ƂȂ�B
�t�E�c���������ł������邪�A�A���ł悭���B���Ă���B�זE�t���܂݁A�Z�����̒��߁A����A���g�V�A���Ȃǂ̒������s���B
�זE�ǁc��ɃZ�����[�X�ƃy�N�`������Ȃ�S�����̖��B���O�j������������Ɩ؉����A�X�y�������܂ނƃR���N������B�\��זE�ł͂����N���債�ăN�`�N��������ꍇ�������B�A���זE���ᒣ�t�ɓ���Ă��n�����Ȃ��̂͂��̍זE�ǂ����邩��ł���B
�Q�D�J���V�E���C�I���ɂ�鐶�̋@�\�ɂ��Ă̗�������Đ�������B
�J���V�E���C�I���͑����̐������ۂɊ֗^���Ă���A�ؓ��̎��k�A�������̊������A�����̊������A�����p���̊������Ȃǂ����̗�ł���B���̒��ŋ؎��k��������悤�Ǝv���B
�@�_�o����̎h���ɂ���čזE���ɋ������N����ƁA�،��@�ۂ����͂ދ؏��E�̂ɓ`�����A�J���V�E���C�I�������o�����B
�A�J���V�E���C�I���̓A�N�`���t�B�������g�ɑ��݂���g���|�j�������̂Ɍ�������B
�B�J���V�E���C�I������������ƁA�g���|�j���ɂ��j�Q��p���Ȃ��Ȃ�A�~�I�V���ƃA�N�`������������B
�C�~�I�V�����q�̓�����ATP�����y�f�iATP�A�[�[�j�Ƃ��ē����AATP������B���̂Ƃ��V������G�l���M�[�ɂ���ăA�N�`���t�B�������g���~�I�V���t�B�������g�̊ԂɊ��荞�݁A�؎��k���N����B���̂��߃T���R���A�̒������Z�k����B
�D�h�����Ȃ��Ȃ�ƃJ���V�E���C�I�����؏��E�̂ɋz������āA�~�I�V���ƃA�N�`���̌����������B���̂��߃A�N�`���t�B�������g�����Ƃ̈ʒu�ɖ߂�A�ؓ��͒o�ɂ���B
�R�D���̂ł̏��`�B�@�\�ɂ��Đ�������B���Ƀz��������p�A�_�o�`�B�@�\�A�I�[�^�R�C�h�ɂ��Đ����w�I�ȋ��ʓ_�𒆐S�ɏq�ׂ�B
�܂��I�[�^�R�C�h�ɂ��Đ����������Ǝv���B�I�[�^�R�C�h�Ƃ͐��̓��Ŏ^������A���ʂő���̖�p���������A�����I�������Ȃ��\���Ɋm������Ă��Ȃ����ߐ_�o�`�B������z�������ɂ͕��ނ���Ȃ�����̕����̑��́B
���̓��ł̏��`�B�́A��ɐ_�o�`�B�����ɂ���ĒS���Ă���B�_�o�`�B�����́A�j���[���g�����X�~�b�^�[�A�_�o���w�`�B�����A���w�`�B�����Ƃ��Ă��B�j���[�����Ő��Y����A���w�I�V�i�v�X�ŕ��o����A�W�I�זE�ɋ����܂��͗}���̉��������������N�����ᕪ�q�ʂ̕����B�m�肵�Ă�����̂͂P�O��قǂŁA�A�~���ށi�A�Z�`���R�����A�m���A�h���i�����A�h�[�p�~���A�Z���g�j���Ȃǁj�A�A�~�m�_�ށi��-�A�~�m���_�A�Q���V���A�O���^�~���_�Ȃǁj�A��X�ȏ��^���q�i�T�v�X�^���XP�A�G���P�t�@�����Ȃǁj������B��ʂɐ������ɕK�v�ȍy�f�͍זE�̂ō����B��L�̂R��ɋ��ʓ_�́A�זE�̓��ō��ꂽ�`�B���������قȃ^���p�N���i��e�^���p�N�j�Ɍ�������B���ꂪ�h���ƂȂ��āA�z��������DNA����]�ʂ��č��o���B�I�[�^�R�C�h��A�_�o�`�B���������o���@�\�����l�ŁA���镨�������Z�v�^�[�Ɍ������邱�Ƃɂ���Ď��̕��������o�����B�܂��A�ߏ�ɍ��ꂽ�Ƃ������Z�v�^�[���������ĕ����̐������~�߂�B�܂��ʂ̕�������p���Ă��A�������Ƃ܂�B���̍�p���A�����ď��`�B���i��ł����B
�S�D���̖��̍\���Ƌ@�\�ɂ��Đ�������B�܂��A���A���̊T�v��Na�{�CCa�{�]ATPase�ɂ��\���A���ł̐��̋@�\�ɂ��Đ�������B
���̖��̓�����������Ƃ��鎉���ƃ^���p�N������ɑa�������ō��o�����\���̂ŁA���n�t���œ��L�̋����`������ɂ͎������s���̖������ʂ����Ă���B���̖��̊�{�\���́A������d�w���f���ł���Ƃ���Ă���B����ɏd�v�Ȃ��Ƃ́A���̖��ɑ����̔����n�̈��q���g�D�I�ɔZ�k�E�z��Ă���A���U�n�i���n�t�j�ł͊��҂ł��Ȃ����������Ɠ��ِ��ŁA�זE�̎��d�v�ȓ����̑�����S���Ă���B�@
���̖��͂��̋��ɕK�v�ȕ�����������A�s�v�Ȃ��̂�r�o����A���̔\�͂����B���̈�����瑼���ւ̗A���ɔ������R�G�l���M�[�ω��i��G�j�́A���̗n���̔Z�x��A����т��ꂪ�d�����ł���ꍇ�͖��ɐ����Ă���d�ʁi�d�C���w�|�e���V�����j�̑o���Ɉˑ�����B��G���O�ŁA�n�����q�܂��̓C�I����Z���ق����甖���ق��֗A��������̂��A���A���̔��Ƀ�G���O�ŗn���̔Z�x���Ɠd�C���w�|�e���V�����ɋt�炤�A���ł͎��R�G�l���M�[�̓����Ƌ������Ȃ���Ȃ炸�A�\���A���Ƃ����B�A���́A����ɔ���ٓI�ɖ��߂���P���g�U�ƁA���ٓI�L�����A�^���p�N�܂��̓`���l������钇��g�U�ɕ��ނ����B����g�U�ł͖����ʂ̔Z�x�����������ꍇ�ł��P���g�U�ɔ�ׂėA�����x�͒����������A�Z�x�����傫���ƍō����x�ɒB����B�L�����A���邢�̓`���l�������ߕ����ɑ��ē��ٓI�ŁA���̓��ٓI�ȑ��ݍ�p�̌`�ł̂ݖ���ʉ߂��邩��ł���B�@�@�@
�����זE�ōזE����K�{�Z�x�������ANa�{�Z�x��Ⴍ�ۂ�ŁA�d�v�ȃ^���p�N��ATP�̃G�l���M�[�𗘗p����̂ŁANa�{/K�{�A��ATPase�ƌĂ��B�����זE�̌`�����Ő�����C�I���Z�x���z�́A�זE�e�ς��ێ����A����A�~�m�_�Ȃǂ̔\���A�����\�ɂ���B����ATPase��ATP���y�f�^���p�N�̃A�X�p���M���_�c��������_�����邱�ƂŁA�y�f���q�̗��̍\����ς��A���̓�������O����Na�{���R�r�o���A�t�ɒE�����_���ɂ�闧�̍\���ω��ɂ��K�{����荞�܂���B�@�@�@�@
5�D������
�@�A���X�e���b�N�^���p�N���c�A���X�e���b�N�G�t�F�N�^�[�ɂ���ċ@�\�̐������^���p�N���̑��́B��Ӌ@�\�A�]�ʒ��߁A�זE�^���A�V�O�i���`�B�ȂǑ��ʂȍזE�@�\�Ɋ֗^����B���������Ɖn�𗥑�����z�X�z�t���N�g�L�i�[�[�́A�G�}���ʂɌ���������̃t���N�g�[�X6-�����_���Ώ̈ʒu�̃v���g�}�[�Ƒ��ݍ�p���邱�ƂŃz���g���s�b�N�Ɉ��艻�����B��������ƒ�e�a���ň���Ȍ`��ɕς�邪�A���̃G�t�F�N�^�[��ADP�͂��̕ω���W����B
�@�A�C�\�U�C���c�C�\�y�f�Ƃ������B����̒��ɓ��ꉻ�w������G�}����y�f���������݂��鎞�A�����Y�y�f�̃A�C�\�U�C���ƒ�`����B���������Ɠ����̓��_�f�q�h���Q�i�[�[�́A2��ނ̃T�u���j�b�g�iM�^�AH�^�j����Ȃ�S�ʑ̍y�f�ł��邽��M4�AM3H�AM2H2�AMH3�AH4�̑g��������5��ނ̃A�C�\�U�C��������B�����̗ʔ�͑g�D�ɂ���ĈقȂ�A���i�ł�M4�A�S�ł�H4�����ꂼ��啔�����߂�B��ʂɃA�C�\�U�C���͊�Ƃ̔������A���Y���j�Q��A���X�e���b�N�G�t�F�N�^�[�̍�p�ɑ��銴�Ȃǂ̓_�ő��݂ɈقȂ�A�זE��g�D���ƂɈقȂ鐶���I�����ɂ��ƂÂ���ӏエ��ё�Ӓ��ߏ�̗v���������Ƃ��o����悤�ɂ��̗ʔ䂪���߂���Ă���B
�@�t�B�[�h�o�b�N�j�Q�c��A�̍y�f�����n�ł��̑�ӌn�̍ŏI�Y�����͂��߂̒i�K��G�}����y�f��j�Q���A�S�̂̔�����}�����邱�ƁB��\��́A�咰�ۂŃC�\���C�V����g���v�g�t�@���̍����n�I�y�����̓]�ʂ������̃A�~�m�_�ŗ}������A���̑O�ɍ������ꂽmRNA�����Ă��A�����y�f�Q�͑��݂��Ă��ăA�~�m�_����葱����B���̂悤�ȉߏ萶�Y��j�~���邽�߂ɃC�\���C�V�����g���I�j���f�q�h���^�[�[��j�Q���A�\���I�j����2-�I�L�\���_��������~���āA����ɑ����C�\���C�V��������4�������i�s���Ȃ��Ȃ�B�g���v�g�t�@�����R���X�~�_���g���v�g�t�@�������o�H�̃t�B�[�h�o�b�N�j�Q����B
�@�q�[�g�V���b�N�v���e�C���c�זE���Y�o����X�g���X�^���p�N����1��ŁA�؍זE�ɔM�X�g���X��������^���p�N���B���̃^���p�N������������Ƌؑ@�ۂ̑������}������A�ؓ��ɂ��}�������\��������ƍl�����Ă���B
�@�Ɖu�ƍR�̍R�������c�Ɖu�Ƃ͑̓��ɐN�������O�E�ɗR������^���p�N�ⓜ�ȂNJO���ٕ���r�����锽���Ƃ���Ă���B���̂��O���ٕ��̐N�������ދ@�\�́A���R�Ɖu�Ɗl���Ɖu�Ƃ�����B���R�Ɖu�͐��̂��{�������Ă���畆�̂悤�ȕ����I�@�\��H�זE��̉t���̎�X�̕��q�ɂ����̂ŁA�l���Ɖu�Ƃ͂����U���܂��͊��������������ɓ��ٓI�Ȃ��̂ŁA�ٕ��ɂ��炳��邱�Ƃɂ���ėU���܂��͊����������@�\�ł���B
�@�R���R�̔����Ƃ́A�R���Ɠ��ٓI�R�̊Ԃ̑��ݍ�p�ŁA�R�������ƍR�̊�����Ƃ̊Ԃɂ͌����e�a��������B�R�̕��q�͂Q���܂��͑����̌�����������A�����̍R���ƌ������ĕ����̂����A�n���R���ł͍R�̂Ƃ̍����䂪�œK�ł���Β��~�����ƂȂ�A�ہA�Ԍ����ȂǗ��q��R���ł͋ÏW�����ƂȂ��Ċώ@�����B
�@�ؓ����k�c�A�N�`���ƃ~�I�V���̗��t�B�������g�̑��ΓI�Ȋ���^���ł���B�~�I�V�������[�^�[�ł���A�A�N�`�������[���ł���B���ׂ�̕����̓A�N�`���t�B�������g�̕������ɂ���ċK�肳��Ă���B���i��S�ł͋،��@�ۓ��̃A�N�`���ƃ~�I�V���t�B�������g�����̋�ԓI�z�u���Ƃ��Ă���B�T���R���A�̒����Ɉʒu����~�I�V���t�B�������g�ւ��̗�������A�N�`���t�B�������g�����荞�ށB���̂��߃T���R���A�m�������Z�k����B�G�l���M�[�̓~�I�V��������ATP�����ɂ���Ă܂��Ȃ���B�؍זE������������Ƌ؏��E�̂���J���V�E���C�I�������o����A�g���|�j���ƌ������ăA�N�`�������������ă~�I�V�������Ƃ̔������J�n�����A����^�����N����B�J���V�E���C�I�������E�̂ɉ�������ƃA�N�`���͕s���������A�o�ɂ���B
�@�h���R�[�������_�c��Ƃ��ē����זE�ɕ��z���Ă�����ʖ����������̂P�ŁA�h���R�[���̖��[�A���R�[��������_�����ꂽ���́B�P���ނ��G�X�e�����������h���R�[�������_�}���m�[�X�Ȃ�тɃh���R�[�������_�O���R�[�X�́A���^���p�N���̃A�X�p���M�������^�����������̓��������ԑ̂ł���h���R�[�������_�I���S���ɁA�e�ʏ��E�̓��o�ɂ����ă}���m�[�X��O���R�[�X��]�ڂ���ۂ̓����^�̊�ƂȂ��Ă���B
�@���m�N���[�i���R�́c�P�N���[���R�̂Ƃ������B�P��N���[���R�̎Y���זE�����傷��R�́B�����P�̍R��������F������R�̂ł���A�ꎟ�\�����ψ�ł���B
�@UDP-���c�k�N���I�V�h���_�̈��ŁA���̍��������ł̎���ł���B�O���R�[�X-�P�����_��UTP�̔����ō����UDP�O���R�[�X�́A�O���R�[�Q�������̊�����A�f�q�h���Q�i�[�[�̍�p�Ŏ_�������ƁAUDP�O���N�����_����B
�@CDP-DG�c�V�`�W���T�f-���_�iCDP�j�ɂP,�Q-�O���Z���[���������������́B�����זE���������������Ɋ֗^���Ă���B
�@GTP�c�O�A�m�V���̃��{�[�X�̂T�f�ʃq�h���L�V�����3���q�̃����_���A�����ăG�X�e�����������k�N���I�`�h�BGTP��GTP�����^���p�N���Ɍ������čזE�O����̃V�O�i���`�B�Ɋ�^����B�^�j�זE���`���[�u�������d�����Ĕ����ǂ��`������ہAGTP�̌������K�v�ł���B�s���r���_����O���R�[�X�������铜�V���̍ۂɂ����p�����B
6�D�^���p�N�������ɂ�鐶�̓��y�f�̊������@�\�ɂ��ė�������Đ�������B
���傳��Ă����̃^���p�N�������y�f�́A�`���[�Q���Ƃ��������̂Ȃ��O��̏�Ԃŕ��傳��邪�A���f�C�I����^���p�N�������y�f�ɂ����蕪���ɂ���ė��̍\�����ω����A�����̂���^���p�N�������y�f�ɂȂ�B
�݂Ń^���p�N��������y�v�V���̓y�v�V�m�[�Q���Ƃ��������̂Ȃ���Ԃŕ��傳��邪�A�ݎ_�Ɋ܂܂�鐅�f�C�I���ɂ����N���[����U�Ԗڂ�Lys�ƂV�Ԗڂ�Ile�̊Ԃ��A���̍\����ω������Ċ����̂���y�v�V���ɂȂ�B
�g���v�V���̏ꍇ�́A���ߊ����̂Ȃ��g���v�V�m�[�Q���Ƃ����`�ŕ��傳��邪�A�\��w���ŃG���e���y�v�`�_�[�[�̂��悤�Ō��蕪������AN���[����V�Ԗڂ̃y�v�`�h�������ؒf����A�����̂���y�v�V���ɂȂ�B�@�@���̑��L���g���v�V����G���X�^�[�[�A�J���{�L�V�y�v�`�_�[�[�̓g���v�V���ɂ����蕪���ŁA������ԂɂȂ�B
|
�`���[�Q�� |
��p���� |
�����^ |
|
�y�v�V�m�[�Q�� |
���f�C�I�� |
�y�v�V�� |
|
�g���v�V�m�[�Q�� |
�G���e���y�v�`�_�[�[ |
�g���v�V�� |
|
�L���g���v�V�m�[�Q�� |
�g���v�V�� |
�L���g���v�V�� |
|
�v���G���X�^�[�[ |
�g���v�V�� |
�G���X�^�[�[ |
|
�v���J���{�L�V�y�v�`�_�[�[ |
�g���v�V�� |
�J���{�L�V�y�v�`�_�[�[ |
�V�D��`�q�̓]�ʃ��x���y�і|�x���ł̐���@�\���������B
�]�ʐ���c��`�q�̓]�ʃ��x�����ɉ����ĕK�v�Ȑ����ɒ��߂���邱�ƁB���j�����A�^�j�����Ƃ��ɓ]�ʗʂ̈Ⴂ�̓v�����[�^�[�\���̈Ⴂ�Ɠ]�ʒ��ߔz��̎�ނƂ��̑g�ݍ��킹�̈Ⴂ�ɂ��N����B�]�ʂ̒��߂͂����]�ʂ̃V�X�G�������g�Ɍ���������q�̊����̋���ɂ�茈�肳���B�]�ʒ��߈��q�͊�{�]�ʑ��u�Ƒ��ݍ�p���邱�Ƃ��ł��A��{�]�ʈ��q�̊�������q�m�`�|�������[�[�̈��艻�Ƃ����X�e�b�v���o�āA�]�ʌ����̒��߂��s���B�^�j�����ł͈�`�q���������邩�ǂ����̑����́A�N���}�`���\�����������Ă��邩�ǂ����Ō��߂���ƍl������B�]�ʒ��߂͓]�ʂ̐L���ߒ��ł��N����A�L�����q���q�m�`�|�������[�[�Ɍ������ċ@�\������B�]�ʒ��߂Ɋ֘A������q�͑��̈��q�ƌ���������A���邢�̓V�O�i���`�B�o�H�̕W�I�ƂȂ�A�����_���Ȃǂ̏C�����邱�Ƃɂ���Ă��̊�����ω������Ă���B�ȏ�̂悤�Ɉ�`�q�̓]�ʃ��x���͕����̒i�K�A�����̈��q�ɂ���Ē��߂���Ă���B
�|�߁c�����`�q�̔�������RNA����^���p�N���֖|���i�K�Œ��߂���邱�ƁB���I�Ȓ��߂ƗʓI�Ȓ��߂�����B�k�P�l���I�Ȓ��߂Ƃ��ĂR�̂��̂�����B�P�j���{�\�[���t���[���V�t�g�F���{�\�[�����|��̓r���ňقȂ�t���[���ɂ����`�q�ɃV�t�g���Ė|��𑱂���B���̌��ʂQ�̃t���[���̗Z���^���p�N��������邱�ƂɂȂ�B�t���[���V�t�g�̕p�x��mRNA�̂��t���[���V�t�g�̉���z��Ƃ��̌�ɑ���RNA�̓\���ɍ��E�����BHTLV-1�̋t�]�ʍy�f�̂悤�Ƀ��{�\�[���t���[���V�t�g��2��s���ď��߂č�p����悤�Ȗ|�߂�����B�t���[���̃V�t�g�����̓��g���E�B���X�ł́|1�A�ۂł́{1�̃V�t�g�������B�Q�j�|��}���F�T�v���b�T�[tRNA�ɂ�钲�߂��m���Ă���B���̏ꍇ�|�߂����`�q�͖|�߂����`�q�͖|��r��ɂ����`�q��mRNA�ƃt���[���͓����ŁA�I�~�R�h���ɃT�v���b�T�[tRNA�������ė��҂̗Z���^���p�N�����|��B�}�E�X�̃��g���E�B���X���t�]�ʍy�f������ۂ̖|���Ō��������B�R�jIRES�F�L���b�v�\���������Ȃ�mRNA�ł�5�f���ɋ߂��R�h���iAUG�j�͕K�������|��̊J�n�R�h���ɂȂ�Ȃ��BIRES�ƌĂ�镡�G�ȓ\��������RNA�ƂȂ�A���̌��AUG���J�n�R�h���ɂȂ��Ė|���B�|���I�E�B���X�A�A���E�B���X�Ȃǂ̃E�B���X�̂ق��A�M�V���b�N�^���p�N���A�V���E�W���E�o�G�̕����Ɋւ���mRNA�ȂǂŌ�����|��@�\�ł���B�k�Q�l�ʓI�Ȗ|�߂Ƃ��ẮA���̂悤�ȗႪ�m���Ă���B���j�זE�ł�RRF���|��ʂ��K�����Ă���B�܂��|���V�X�g������`�q�ł�tRNA�ɂ��㕔�V�X�g�����̖|��ʂ��K�������B����^�j�זE�ł̓t�F���`��mRNA�̂悤�ɓS�C�I���̑����ɂ���Ė|��}���^���p�N�����S�ƌ������Ė|��ʂ������������m���Ă���B������mRNA�̖|��ʂ̓J���V�E���E�F�[�u�Ɉˑ����Ă���B�y���GCN4��`�q�ł�mRNA�ɖ|��̃G���n���T�[���ʂ�����A�����Ƀ^���p�N�����������ĉ����̖|��ʂ����i�����B���㗬�Ŗ|�ꂽ�y�v�`�h�ʂ����S��`�q�Y���ʂɉe������B�܂�3�f��|��̈�̉���z��ɂ����mRNA�̈��萫���K������Ă���A���ɂ��̕��ʂ�AU�ɕx�ނ�RNA�͕s����ł��̌��ʂƂ��Ė|��ʂ�������B
�W�D�_�f��Q�A����Q�A��Q�̖h��ɂ��Đ�������B
�_�f��Q�h��c�D�C�����ɂƂ��Ď_�f�͐����Ă�����ɕs�������A���Ɋ댯�ȕ����ł���B�Ⴆ�Α��s�O�a���b�_�͔�_�f�I�Ƀq�h���y���I�L�V�����Ɏ_������A����ɕ������āA�X�[�p�[�I�L�V�h�Ƃ������W�J���C�I������B���̂ق��l�X�ȉߒ��ŃX�[�p�[�I�L�V�h����������B�����h�����߂ɐ��̂ɃX�[�p�[�I�L�V�h�W���X�^�[�[������A���₩�ɃX�[�p�[�I�L�V�h���ߎ_�����f�ɕ�������B�ߎ_�����f�̓J�^���[�[�̍�p�Ŋ��S�ɖ��ʼn������B
�X�[�p�[�I�L�V�h�W���X�^�[�[
�QO2�|�{�QH�{��H2O2�{O2
�J�^���[�[
�QH2O2���QH2O�{O2
����Q�h��cDNA�����O���ɏƎ˂����ƃ`�~����ʑ̂��`������A����͂��̕��ʂł�DNA������W����B���̂Ƃ����ٓI�ȃG���h�k�N���A�|�[���`�~����ʑ̂�F�����āA���̕t�߂�DNA��ؒf����B�����DNA�|�������[�[�T��5�f��3�f�G�L�\�k�N���A�|�[�Ƃ��ē����A��Q�������ʂ���菜���Ɠ�����DNA�������������A���Ƃ̉����������B�Ō��DNA���K�[�[���M���b�v�߂�A���ʂ��DNA�ƂȂ�B
��Q�h��c�זE�ɂƂ��Ė�i�͈ٕ��ł���A�����Ԏc�����Ă��Ă͗L�Q�ł���B�~�ς����Ȃ��悤�������r�o������K�v������A�r�o���₷�����q�ɕς���̂͊̑��ł���B�̃~�N���\�[���̃V�g�N����P450�Ƒ��̂�����A�̍y�f�ɂ��q�h���L�V�������BP450�̓w���^���p�N�ŁA�~�N���\�[���d�q�`�B�n��NADPH���狟�������d�q���g���A��iRH�j��O2�Ńq�h���L�V������B���̓d�q�`�B�ł̓~�g�R���h���A�Ƃ͈ႢATP���Y�Ƌ������Ȃ��B
RH�{NADPH�{H�{�{O2��ROH�{NADP�{�{H2O
��̎�ނɉ�����P450������B�Ⴆ�ΐ�����t�F�m�o���r�^�[���p����ƁA������q�h���L�V������A���[���q�h���L�V���[�[���U�������B�q�h���L�V�����ꂽ�U���̂͐��n���̃O���N�����_�����̂◰�_�G�X�e���ɕς����A�A���r�������B�O���N�����_�����̂�UDP�O���N�����_����̓]�ڔ����ō����B�������x���]�k���l�s������P450�n�ŃG�|�L�V�������ƁA��ł̋t�Ŕ������ɕϐg����B
�X�D���f�T�C�N���̊T�v���������B�܂����̓��̔A�f�����o�H���������B
���f�T�C�N���c���������ʂƍזE�����͕�������B�^���p�N���̓A�~�m�_�ɕ�������A����ɃO���^�~���_�f�q�h���Q�i�[�[��A�~�m�_�I�L�V�_�[�[�Ȃǂ̍�p��NH3�܂���NH4�{��V������B�y��ɂ�NH4�{�����Ɏ_�C�I���Ɏ_������Nitrosomonas�A���Ɏ_�C�I�����Ɏ_�C�I���Ɏ_������Nitrobactor�����ANH4�{�͑��₩�ɏɎ_�C�I���ɂȂ�B������ɉ��Ƃ����B
NH4�{�{3�^2O2��NO2�|�{H2O�{2H�{�@�@�@��G0�����|275kj�^mol
NO2�|�{1�^2O2��NO3�|�@�@�@�@�@�@�@�@�@��G0�����|74kj�^mol
�����̋ۂ�CO2���瓜���A�����琶�̐�������������B���̍����o�H�̓J���r���]�x���\����H�Ƒ卷�Ȃ����A�G�l���M�[�͌��ł͂Ȃ�NH4�{�̎_�������ŋ��������B���̂悤�ɂ����͊ȒP�ȒY�f���⒂�f������̐�������������Ɨ��h�{�����ł���B�A������������Ɏ_�C�I���∟�Ɏ_�C�I�����z������A�ĂуA�����j�A�ɊҌ�������̐����̍����Ɏg���B������I�Ɏ_�Ҍ��Ƃ����B�܂������̓y��ۂ͎_�f�̕ς��ɏɎ_�C�I���∟�Ɏ_�C�I�����_���܂Ƃ��ėL�@���q���_�����ăA�����j�A����ATP�Y����B������ى��I�Ɏ_�Ҍ��܂��͏Ɏ_�ċz�Ƃ����B�����̍ۂ͈��Ɏ_�̊Ҍ��Œ��f���A��C�ɖ߂��B�����E���Ƃ����B�������Ē��f���q�͒n�����z����B���ꂪ���f�T�C�N���ł���B
�A�f�T�C�N���c�A�~�m�_�Ȃǂ̒��f�_���������������ƁA�A�~�m���L�łȃA�����j�A����������B�A�����j�A�̈ꕔ�̓O���^�~���_�f�q�h���Q�i�[�[�̍�p��2�]�I�L�\�O���^���_�Ɉڂ�A�O���^�~���_�Ƃ��čė��p����邪�A�c��͊̑��̔A�f�T�C�N���Ƃ�����ӌo�H�œŐ��̒Ⴂ�A�f�ɕς����Ă��猌�t�Őt���ɑ����A�A���ɔr�������B�A�f�T�C�N���̓T�C�h�]���ƃ~�g�R���h���A�̋�����ƂŁA�ŏ��ɇ@�A�����j�A���~�g�R���h���A��2��ATP������ē�_���Y�f�ƌ������A�J���o���C�������_�ƂȂ�B�@�A�I���j�`���ƌ������ăV�g�������ɂȂ��ăT�C�h�]���ɔ����o���@�B����1��ATP������ăA�X�p���M���_�Ɣ�������@�C�A���M�j���Ɏp��ς��Ă���@�D����M�i�[�[�̍�p�ŔA�f�ɂȂ�B���̂Ƃ��I���j�`�����Đ�����A�I���j�`���̓~�g�R���h���A����̗A���^���p�N�ɂ��A�~�g�R���h���A���ɖ߂�B�A�����j�A�̔p���̕��@�͓����̐������i���ɐ��̗ʁj�ɔ������Ă���A���㓮���͔A�f�A���̏��Ȃ����ɏZ�ޗ���n���ނⒹ�ނ͐��ɗn���ɂ����A�_�A���ɏZ�ދ��ނ̓A�����j�A�̂܂܂Ŕr�o����B
�P�O�D���̓��ɂ�����I���S�y�v�`�h����у^���p�N���̐����@�\���������B
�@�^���p�N���̐������͑����̈��q�֗^�̂��Ƃɕۑ�����Ă���DNA���𐳊m�ɖ|�ď���̃^���p�N���Ƃ��ĕ\������B�זE���ł͖������^���邢�͗V���^���{�\�[����ōs���Ă���B�@�P�j�����̑��i�K�̓A�~�m�_�̊������i�K�ł���A�Q�O��̃A�~�m�_���e�A�~�m�_�ɓ��ٓI�ɑΉ�����tRNA�̂R�f���[�̃��{�[�X�ɃG�X�e�������Ō������A�A�~�m�A�V��tRNA�ƂȂ�i�K�ł���B�@�Q�j��Q�i�K��DNA�̂�����]�ʂ��邱�Ƃɂ�萶����mRNA�����{�\�[���ƌ������A�J�n�����̂��`������B���̒i�K�ɂ̓��`�I�j��tRNA�A���邢�͑����̃|���y�v�`�h���J�n���q�AGTP�CMg2�{�Ȃǂ��֗^���A�����ATP���֗^����B�@3�j��3�i�K��mRNA�̃R�[�h�����`�Í��ɂ��������ăy�v�`�h�����L�тĂ����i�K�ł���A�|���y�v�`�h���������q�AGTP�CMg2�{�̑��݉��Ɉ�`�Í��̓A�~�m�A�V��tRNA�̎����A���`�R�h���̉������ăA�~�m�_�̔z���ɖ|��A���{�\�[���T�u���j�b�g���ɑ��݂���y�v�`�W���g�����X�t�F���[�[�̍�p�Ńy�v�`�h�������`�����A�y�v�`�h���������������Ă����B���̒i�K�ŁA�y�v�`�h�������������I���S�y�v�`�h���`�������B�@�S�j��S�i�K�̓y�v�`�h���������I������i�K�ł���B��R�i�K�Ńy�v�`�h���������������AmRNA�̎����Í����I�~�R�h���ɒB����ƃ|���y�v�`�h���I�����q�̍�p�ŐV���|���y�v�`�h����tRNA����ؗ�����A���{�\�[������V������B�@�P�j�`�S�j�̉ߒ���ʂ���mRNA�͂T�f���R�f�����ɓǂݎ���A�܂��y�v�`�h����N���[��C���[�̕����ɍ�������Ă���B���{�\�[������V�������V���|���y�v�`�h���͎�X�̏C�����A���������^���p�N���ɂȂ邪�A����ɂ�N���[�̉����̃A�~�m�_�̏��������N���[�A�~�m�_�̃u���b�N�AS�]S�����̐V���ɂ�镪�q�ˋ��A�����_���A���`�����A�O���R�V�����A����ɂ͓��ٓI�y�v�`�_�[�[�ɂ�镪���A���̃|���y�v�`�h���Ƃ̉�Ȃǂ��܂܂��B
�P�P�D�E�A�~�m�����A�A�~�m��]�ڔ����ɂ��Đ�������B
�E�A�~�m�����c�A�~�m��̐ؒf�������w�����B�_���I�����Ɣ�_���I�����ɑ�ʂ���A��ȗl���́A�k�P�l�_���I�����F�A�~�m��y�f�I�ɒE���f����Đ������C�~�m��̉��������ɂ��A�����j�A�̐����B�i��G�O���^�~���_�f�q�h���Q�i�[�[�A���m�A�~���I�L�V�_�[�[�j�@�k�Q�l��_���I�����F�P�j�E�������ɂ��A�����j�A�̗L���Ɠ�d�����̐����B�i��G�q�X�`�W���A�����j�A�]���A�[�[�j�A�@�Q�j�A�~�m����������i��G�A�f�m�V���f�A�~�i�[�[�A�O���^�~�i�[�[�j�A�@�R�j�y�f�I�E�������Ő��������ԑ̃C�~�m��̉��������i��GL-�Z�����f�q�h���^�[�[�j�A�@�S�j�A�~�m��]�ڔ����ɂ����鋟�^�̂���̃A�~�m��ؒf�i��G�A���j���A�~�m�g�����X�t�F���[�[�j�B
�A�~�m��]�ڔ����c��ʓI�ɃA�~�m�_�̃A�~�m����P�g�_�ɓ]�ڂ��锽���ŁA�Y�f���i�̓G�l���M�[���ɁA�A�~�m��͔A�f�ɑ�ӂ���钆�S�I�Ȕ����ł���B�����̃A�~�m�_�̃A�~�m��͂������ăO���^�~���_�ɏW�߂���B�܂��t�ɃP�g�_�ɃA�~�m������^����X�̔�K�{�A�~�m�_���`�����邱�Ƃ��ł���B�����̃A�~�m�_�`���ƕ����̓A�~�m�g�����X�t�F���[�[�ɂ���čs���A�����y�f�ʂ̓^���p�N���ێ�ʁA�z�������ɂ��ϓ�����B
�P�Q�D���A�~�m�_�ƕs���A�~�m�_�̍\���ƈӖ����ڋL����B
�s���A�~�m�_�c�����̐���Ȑ����⒂�f���t�̈ێ��ɕK�v�ȗʂ�����������Ȃ����߁A�H���Ȃǂ̌`�ŊO�E����ێ悷��K�v�̂���k-�A�~�m�_�B���l�ł́A�C�\���C�V���A���C�V���A���V���A���`�I�j���A�t�F�j���A���j���A�g���I�j���A�g���v�g�t�@���A�o�����̂W��ށB������n���b�g�ł̓q�X�`�W���������A�������̃��b�g�ɂ͂���ɃA���M�j�����K�v�Ƃ����B�t�F�j���A���j����`�I�j���͑�ӌo�H���A���ꂼ��̎��v�̈ꕔ���`���V���A�V�X�e�C���ɂ���đ�p�ł���B�^���p�N���h�{�̊ϓ_����͐ێ�ʂƂƂ��ɁA�e�K�{�A�~�m�_�̐ێ抄�����d�v�ƂȂ�B
���A�~�m�_�c�s���A�~�m�_�Ƃ͈قȂ�A�A�~�̃g�����X�t�@�[�[�ɂ��A�~�m�_�̐������ŕK�v�ʂ��܂��Ȃ���A�~�m�_�B���l�ł͕s���A�~�m�_�̎c��̂P�Q��ނ̃A�~�m�_�B
�P�R�DDNA��RNA�̕����@�\�ɂ��ďq�ׂ�B
�j�_�̕����̓k�N���A�[�[�ƌĂ��y�f�ɂ���čs����B�k�N���A�[�[�̂����j�_������Ƃ��ɁA���̓r����ؒf����y�f���G���h�k�N���A�[�[�A�[����P�Â藣���Ă����y�f���G�L�\�k�N���A�[�[�ƌĂԁB�����̃k�N���A�[�[�̂����ADNA��������������������̂��f�I�L�V���{�k�N���A�[�[�iDN�A�[�[�j�ARNA��������������������̂����{�k�N���A�[�[�iRN�A�[�[�j�Ƃ����BDNA��RNA�̗��҂�������̂͒P�Ƀk�N���A�[�[�ƌĂ��B�z�X�z�W�G�X�e��������������������Ƃ��ɂ͍y�f�̓��ِ��ɂ���ĂT�f�ʂɃ����_��c��R�f�ʂɃq�h���L�V�������ꍇ�ƁA�t�ɂR�f�ʂɃ����_��c��T�f�ʂɃq�h���L�V�������ꍇ����B�G�L�\�k�N���A�[�[�ɂ͂قƂ�lj�����ِ����Ȃ����A�G���h�k�N���A�[�[�ɂ͉���ɔ���ٓI�ȃk�N���A�[�[�ƁA���鉖��邢�͉���z���F�����Ċj�_���̓��ٓI�ȕ��ʂ݂̂�ؒf����k�N���A�[�[�̂Q��ނ�����B�Ⴆ�ARN�A�[�[T1�̓O�A�j���_��3�f���݂̂Őؒf����̂ŁA�������I���S�k�N���I�`�h��3�f���[��Gp�ł���BRNA���ꎩ�g��RN�A�[�[�����������̂����o���ꂽ�B
�P�S�DDNA��RNA�̍����@�\�ɂ��ďq�ׂ�B
DNA�̍����cDNA�̍����ɂ͑����̍y�f���K�v�ł���B�咰�ۂ̏ꍇ�ł�20����̍y�f���������Ă���B�����̊J�n�⍽�̉��������ɂ����āA���傤�Ǖ������N�����Ă��镡���t�H�[�N���ʂł͓�d�点�قǂ���K�v������A���̂��߂ɂ͂��̕��ʂō��̉�]���N���Ȃ���Ȃ�Ȃ��B����ɂ�DNA�g�|�C�\�����[�[�Ƃ����y�f���֗^����B����1�ł���X�E�B�y���[�[�͂��̕�����DNA�̊��ق�����G�}���邪�A����ɂ�DNA�̃z�X�z�W�G�X�e�������̐ؒf�ƍč������������ċN���邱�Ƃ��K�v�ŁA37����4000�`5000��^min����]���N����BDNA�W���C���[�X�Ƃ����y�f��ATP�̕����Ƌ������āA���S�ɕ��ăX�[�p�[�R�C���\�����Ƃ�DNA�ɂ˂�������邱�Ƃ�G�}����B�̃{�r�I�V���Ƃ����R�������͂��̍y�f����ٓI�ɑj�Q���A�����ɕ������j�Q����̂ŁADNA�̃X�[�p�[�R�C���\���������ɏd�v�ȓ��������Ă��邱�Ƃ�������Ă���B
RNA�̍����cRNA�̍�����RNA�|�������[�[�Ƃ����y�f�ɂ���čs����B���j������RNA�|�������[�[�́ARNA������S���R�A�y�f�ƁA�v�����[�^�[��F������ЃT�u���j�b�g����Ȃ�B�R�A�y�f�ƃЃT�u���j�b�g�̕����̂��z���y�f�ƌĂсA�z���y�f�������v�����[�^�[����̐������]�ʂ�����B�R�A�y�f�̓�2�����f�̃T�u���j�b�g�\���������ARNA�����̐G�}�������S�̓��T�u���j�b�g�ɂ���B�T�u���j�b�g�̓�2����2������2�����f�i�����n�R�A�y�f�j�������R�A�y�f�̌o�H�ŏW������B����ЃT�u���j�b�g�ɂ́A�v�����[�^�[�F�������̈قȂ鑽�^����������B��Q�̈�`�q�̓]�ʂ͓]�ʈ��q�ɂ���Ę��i�܂��͗}������A���̒��߂܂��͕��̒��߂ƌĂ��B�]�ʈ��q��DNA�Ɍ������A���̍\���ϊ�����ē]�ʂ𐧌䂷�邩�A�܂���RNA�|�������[�[�ɒ��ڍ�p���A���̊�����v�����[�^�[�F�������𐧌䂷��
�P�T�DHAT�|�n��p�����n�C�u���h�[�}�זE�̑I�ʋ@�\�ɂ��Đ�������B
�n�C�u���h�[�}�זE�Ƃ͎G��זE�̂��Ƃł���A��b�I�ȉ�͏�ŗL�p�Ȃ��̂ł��邪�A�o���p�x���Ⴂ�B���̎擾���@�̂P�������̍זE�̒�����G��זE��I�яo�����@�ŁA�k�N���I�`�h�������n�y�f�̓ˑR�ψق𗘗p����B�v���������T���x�[�W�o�H�̍y�fHGPRT�������A�`�~�W���������_������y�fTK�������Ȃ��זE�ƁA�t��TK�������AHGPRT�������Ȃ��זE���A���ꂼ��P�Ƃł�HAT�|�n�ɐ���ł��Ȃ����A�G��זE�ɂȂ�ΐ���ł��邱�Ƃ����p����B
�P�U�D���b�_�̍����n�A����������TG�̍����n�ɂ��Đ�������B
���b�_�̍����n�c���b�_�̍����n�ł͑����̃X�e�b�v���J��Ԃ����A�����g�D�ł͎��b�_�V���^�[�[�Ƃ������y�f�����̂̒��ɕK�v�ȑS�y�f�ƕ���q���Z�b�g����Ă���B�@�A�Z�`��-CoA�̃A�Z�`������b�_�V���^�[�[�����́iE�j��ACP�Ɍ���������A�A���������̂�Sys����SH��Ɉڂ��ăA�Z�`���]S�]Cys�]E���`������BACP��CoA�Ɠ��l�Ƀz�X�z�p���e�e�C��������A�A�V������������鏬�^���p�N�����A�Ɨ��^���p�N�ł͂Ȃ����b�_�V���^�[�[�����̂̈ꕔ���Ȃ��B�B�}���j���]CoA�̃}���j���ACP�ɏ�芷���āA�}���j���]ACP�����ƁA�C�A�Z�`���]S�]Sys�]E�̃A�Z�`����}���j���]ACP��CO2�����A�k�����ăA�Z�g�A�Z�`���]ACP���`������B�DNADPH�ɂ��Ҍ���3�]�q�h���L�V�u�`�����]ACP�����A�E�E�������œ�d���������u�e�m�C���]ACP�Ƃ���B�F������ēxNADP�ŊҌ����u�`�����]ACP�Ƃ���B�G�����Ńu�`����������̂�SH��Ɉڂ��ău�`�����]S�]Sys�]E���Ȃ킿C4�]���b�_�̗U���̂����̂�1�T�C�N���ł���B���̐�͍ĂчB�}���j���]ACP�̌`���C�u�`������ƃ}���j���]ACP�̒E�Y�_���k���A�D�Ҍ��A�E�E���A�F�ĊҌ��ɑ����A�G�����̂�SH��ɏ�芷����C����2�����AC6�̃w�L�T�m�C���]S�]Sys�]E�����B���l�̔����T�C�N�����J��Ԃ��AC16�̃p���~�g�C���]ACP�܂ō��������т�ƁA���������Ńp���~�`���_����B�������Č����̃A�Z�`���]CoA�ƃ}���j���]CoA��^����A�p���~�`���_���ł���B
17�D������ӂɊւ���̑��̋@�\���グ��B�܂��̑��̎��b�ʂ����E������q���グ���������B
�S�⍜�i�̓G�l���M�[���Ƃ��ăO���R�[�X�̂ق��ɃA�Z�g�|�_��3-�q�h���L�V���_�����p����B�]���O���R�[�X�̋������s�������3-�q�h���L�V���_�𗘗p����B�̑��͂����̎_���������邪�A��ӂ͂��Ȃ��B�A�Z�g�|�_�́A�A�Z�g�A�Z�`��CoA����ł���B�A�Z�g�A�Z�`��CoA�͎��b�_�̃��_���Ƃ͕ʂɊ̃~�g�R���h���A�̃}�g���N�X�ɂ���A�Z�`��CoA�A�Z�`���g�����X�t�F���[�[�̍�p��2�̃A�Z�`��CoA�����Ɣ��ŏk�����č��������B�̃~�g�R���h���A�ɂ̓A�Z�g�A�Z�`��CoA��3-�q�h���L�V-3���`���O���^�����]CoA�iHMG�|CoA�j���o�āA�A�Z�g�|�_�ɕς���y�f��A�Z�g�|�_��NADH��3-�q�h���L�V���_�ɊҌ�����y�f������B�A�Z�g�|�_�̈ꕔ�͔�y�f�I�ɒE�Y�_���ăA�Z�g���ɂȂ�B�A�Z�g�|�_�A3-�q�h���L�V���_�A�A�Z�g����3�҂��P�g���̂Ə̂���B
�̑��̎��b�ʂ̒��߈��q�Ƃ��Ă̓P�g���̂��グ����B�����P�g���̂͏d�v�ȃG�l���M�[���ł��邽�߁A���t���̃P�g���̔Z�x���Ⴂ�ꍇ�́A�G�l���M�[���s��������ԂƂȂ�A�̑��ł̎��b�_�̐��������i����錋�ʃP�g���̔Z�x�͏㏸����B�t�ɍ��Z�x�̏ꍇ�́A�̑��ł̎��b�_�������}������A���ʓI��TG�i�������b�j���~�ς����B
18�D�R���X�e���[���̐������n���������B�܂��A���̓��R���X�e���[���̎�ȑ�ӌo�H��������A���̑�ӎY���̋@�\�ɂ��Đ�������B
�R���X�e���[���̐������c�R���X�e���[���̐������o�H�ł́A3-�q�h���L�V-3-���`���O���^����-CoA�iHMG-CoA�j�����p�����_�ɊҌ�����锽�����J�n�ߒ��ƂȂ�B���̔�����G�}����HMG-CoA���_�N�^�[�[�́A�H�a���̃R���X�e���[���ɂ���āA���̊����Ƃ��̐������̑o�����}�������BHMG-CoA�ƍ\�����ꕔ�ގ����Ă���R�������R���p�N�`���́A���̔����������j�Q����̂ŁA���R���X�e���[�����ǂ̎��ÂɗL�p�ł���B���p�����_����ꕔ�̊������A�k������ѕ̔����ɂ���ăR���X�e���[������������B
�R���X�e���[���̓v���Q�X�e�����A�R���`�]�[���A�A���h�X�e�����A�e�X�g�X�e�����A�G�X�g�����Ȃǂ̊e��̃X�e���C�h�z�������̑O��̂ł�����B�e�z�������͂���߂ďd�v�Ȃ��̂ł���A�����̍����y�f��1�ł���������ƁA����Ȑ����炪���Ȃ���ȂǗl�X�Ȑ�V���Ǐ����B�܂��R���X�e���[���͒_�`�_����A�J���V�E������_�̑�ӂɕK�v�ȃr�^�~��D�̑O��̂ł�����B
|
�X�e���C�h�z�������� |
�@�\ |
|
�v���Q�X�e���� |
�q�{�S���ɍ�p���A���q�������\�ɂ��鉩�̃z������ |
|
�R���`�]�[�� |
�O���R�[�Q���������i�A�^���p�N�E���b�̕��𑣐i����O���R�R���`�R�C�h |
|
�A���h�X�e���� |
�t���ł̊e��C�I���̍ċz���𑣐i����~�l�����R���`�R�C�h |
|
�e�X�g�X�e���� |
�j���̓����B������j���z������ |
|
�G�X�g���� |
�����̓����B�����鏗���z������ |
19�D�O���I�L�V���_�T�C�N���ɂ��Đ�������B
�����A������є������Ɍ������ӌo�H�B�A����q�̔��莞�A�|�_��Y�f���Ƃ���������̐��玞�ɗU������A�������b�̗��p�AC4�������̐����Ɋ�^����B�C�\�N�G���_���A�[�[�ɂ��C�\�N�G���_�̊J��A�����S�_�V���^�[�[�ɂ��O���I�L�V���_�ƃA�Z�`��CoA����̃����S�_�̍�����2�����ɂ��A�N�G���_��H�̒E�Y�_�ߒ����o�C�p�X�����Z����H���`������B���̉�H�̍y�f�����̓O���I�L�V�\�[���ƌĂ��זE���튯�ɋǍ݂���B
20�D������ӂ̊T�v���������B
����ӂ͉n�A�N�G���_��H�A���f�`�B�n����Ȃ�B
�n�c���_�f�I����ӂ̎�v�o�H�ŁA�O���R�[�X�܂��̓O���R�[�Q�����炻�̃����_�����ԑ̂��o�āA�s���r���_�ɂ܂ŕ�������13��̍y�f����`�������y�f�n�ł���B1���q�̃O���R�[�X��2���q�̃s���r���_�ɕ��������B�������s����Ƃ��ɂ�52kcal/mol�̎��R�G�l���M�[���������邪�A�n�ł�2���q��ATP�����������B�O���R�[�Q������o�������ꍇ�́A���@�����_���z�X�z�����[�[�ŃO���R�[�X-1-�����_���`�����邽�߁A3���q��ATP���`�������B���̌o�H�ł͂͂��߂�2���q��ATP�̃����_�G�X�e�����ɏ���A�t���N�g�[�X�r�X�����_���A���h���[�[�ŕ�������B���̌�2���q�̃g���I�[�X�����_��E���f����i�K��2���q�̖��@�����_���������A�z�X�z�O���Z�����_�L�i�[�[�ƃs���r���_�L�i�[�[�̒i�K�ō��v4���q��ATP��B���̍y�f�͑S�ăT�C�g�]���ɗn�����Ă���B
�N�G���_��H�c��ӊ���N�G���_���o�čŏI�I�ɐ��Ɠ�_���Y�f�ɕ��������H�B�זE���̎�v�ȉh�{�f�͂܂��זE�t�œ��A�O���Z���[���̓s���r���_�ɁA���b�͎�Ɏ��b�_�Ƀ^���p�N���̓�-�P�g�_�ɂ܂ŕ�������Ă��̉�H�ɓ���B�����Ă��̑啔������`�������A�Z�`��CoA�́A�N�G���_��H�ɂ���ĒY�f�����͒E�Y�_����A���f�����͒E���f�y�f�Ŏ��NADH�Ƃ��ă~�g�R���h���A�����̓d�q�`�B�n�ɓn�����B���̉�H�̓~�g�R���h���A�̃}�g���N�X���ɑ��݂��邪�A�R�n�N�_�f�q�h���Q�i�[�[�����̓~�g�R���h���A�����̓d�q�`�B�n�Ɋ܂܂��B��H�́A�A�Z�`��CoA���I�L�T���|�_�Ək�������ăN�G���_�Ƃ��A�Ȍ�4��̒E���f�A2��̒E�Y�_���o�āA�Ăт��Ƃ̃I�L�T���|�_����B���̃I�L�T���|�_��p���Ď��̃A�Z�`��CoA���ӂ��邱�Ƃ��ł���B���̊�3��̃g���J���{���_�A6��̃W�J���{���_���o�邽�߂ɁATCA��H�̕ʖ�������B���̉�H�͍D�C���̈ى��̒�����H�ł����āA��H1��H�œ�����3���q��NADH2��1���q�̃R�n�N�_����11���q��ATP��B����ɃX�N�j�V��CoA�V���e�^�[�[�̒i�K��ATP�ɑ�������GTP��1���q�`������B������̉�H�͓����ɂ��d�v�Ȉʒu���߂�B���A�~�m�_�A�w�������Ȃǂ̖����̍��������̊�̋����n�ƂȂ��Ă���B�܂������̓�������������z�X�z�G�m�[���s���r���_���������ē��V���̏o���_�ƂȂ�B
�d�q�`�B�n�c���̓��Ŋ�̎_���Ҍ������͒E���f�A�d�q�`�B�A�_�f�Y����3�킠��B���̒��ŃG�l���M�[�l���Ɋւ�����̂͒E���f�Ɠd�q�`�B�ł����āA�_�f�Y���̓X�e���C�h�������łɗp������B�d�q�݂̂�����^���p�N��������A���̂����Ńw���������̂��V�g�N�����Ƃ����B�V�g�N�����ɂ�aa3�Cb�Cc�Cc1�Ȃǂ�����B�w���łȂ��S�𗘗p����d�q�`�B�̂���w���S�ł���A���ɓ��^���p�N��������B�d�q�`�B�n�͖����̊�̒E���f�ő����Ă���H��H�{��e�|�݂̂�d�q�`�B�̂̏W�����Ȃ킿�d�q�`�B�n�Ŏ_������B���̓d�q�`�B�̂�4��̕����́i�T�C�U�C�V�C�W�j�ɕ������B�����̇U�͓d�C���w�I�v���g�����z�`���͂��Ȃ��B�����̇T��FMN�Ɣ�w���S���܂݁ANADH���_�����ĕ�y�fQ�iCoQ�j���Ҍ�����B�����̇U��FAD�Ɣ�w���S���܂݃R�n�N�_���_������CoQ���Ҍ�����B�������Đ������Ҍ��^��CoQ���̇V���_�����ăV�g�N����c���Ҍ�����B�����ĕ����̇W���Ȃ킿�V�g�N�����I�L�V�_�|�[���Ҍ��^�V�g�N����c�̓d�q�ƁAH�{��O2�Ŏ_������H2O����̂ł���BCoQ�͖������ɗn���ĕ����̊Ԃ̎_���Ҍ���}��A�V�g�N����c�@�͖��ԍo�̐����ɗn���ĕ����̇V�C�W�Ԃ̓d�q��`�B����B
21�D�f���v������уO���R�[�Q���̑�Ӂi�����n����э����n�j�Ɋւ���y�f�̎�Ȓ��ߋ@�\�ɂ��Đ�������B
�؍זE�ł͌��t����O���R�[�X����荞�݃w�L�\�L�i�[�[�ŃO���R�[�X6-�����_�iG6P�j�ɕς���ƁA������O���R�[�X�ɖ߂��Ȃ��BATP�ɗ]�T�������G6P����G1P�Ȃǂ��o�ăO���R�[�Q�����������Ē������A�t��ATP�̎��v��������O���R�[�Q������G1P���o�ĉn��G6P�������������B���꒲�߂���̂��O���R�[�Q�������y�f�z�X�z�����[�[�ƁA�����y�f�O���R�[�Q���V���^�[�[�ł���B���̗��y�f�̓����_����������邩�A�͂������Ƃ��������_��/�E�����_�̋��L�����C���ɂ�蒲�߂����B�����_���^���������A�E�����_�^���������͊e�y�f�^���p�N�Ǝ��̐����ł���B�z�X�z�����[�[�̓����_���y�f�i�z�X�z�����[�[a�j�������Ȃ̂ɑ��A�O���R�[�Q���V���^�[�[�͒E�����_�^�������ł���B�����ʼn��炩�̎d�|���ŗ��y�f���Ƀ����_���^�ɕς�������������ǂ�O���R�[�Q���V���^�[�[�͕s�����ƂȂ�A�����ς�z�X�z�����[�[�m��p�ŕ������i�ށB�t�ɗ������ɒE�����_����A�O���R�[�Q���̕������}�����G6P�������ɂ������ƃO���R�[�Q�������������͂��ł���B���̂���������̂��z�������ł���B
���ʂ�ATP���K�v�ȂƂ����t����G�s�l�t�����Ƃ����z�����������傳��A�W�I�̋؍זE�ɒB���A�`������ʉ߂��ăz���������Z�v�^�[�ƌ������ăR���t�H���[�V������ς���B�R���t�H���[�V������ς���Ɨאڂ���s�����^�A�f�j���T���V�N���[�[�ɉe�����y�ڂ��Ă���������^�ɕς���B���̍y�f��ATP����cAMP���ʐ��Y����BCAMP�̖����͕s�����v���e�C���L�i�[�[A�����������邱�Ƃɂ���BCAMP�����߃T�u���j�b�g�ƌ������čy�f���������G�}�T�u���j�b�g��V������Ƒ����̃z�X�z�����[�[�L�i�[�[�ƃO���R�[�Q���V���^�[�[�������_�������B�����_�����ꂽ�z�X�z�����[�[�L�i�[�[�̓z�X�z�����[�[b���z�X�z�����[�[a�ɕς���B�������ăz�X�z�����[�[�ƃO���R�[�Q���V���^�[�[�̗��y�f�������Ƀ����_������錋�ʃO���R�[�Q�������n�������A�n�Ɋ������AATP���Y�n���t�����Ƃ��n�߂�BG�^���p�N����������GTP��������������������GDP�ɕς���ƃz�������h������O�̏�Ԃɖ߂�B
22�D�y���g�[�X�����_�T�C�N���̈Ӌ`�ɂ��Đ�������B
�@�@�O���R�[�X��ӌo�H�̂P�B�����������ɕK�{�̊Ҍ��͂ł���NADPH�A���{�[�X�T-�����_�𑼂̃y���g�[�X�����_�̋�������v�Ȗ����Ƃ���B�O���R�[�X�U-�����_���_���I�ɒE�Y�_���A���u���[�X�U-�����_��NADPH�����A�̔����ƁA�R���q�̃y���g�[�X�����_����Q���q�̃t���N�g�[�X�U-�����_�ƂP���q�̃O���Z���A���f�q�h�R-�����_����t�I��������Ȃ�B�t�I�����̐i�s�͍זE����NADP�{���x���ɂ���Đ��䂳��Ă���B
23�D���V���ɂ��Đ�������B
���_�A�A�~�m�_�A�O���Z���[���Ȃǂ̔�Y�����������V���ɃO���R�[�X����������邱�ƁB�]�̓O���R�[�X��B��̃G�l���M�[���Ƃ��邽�߁A�O���R�[�X�̐₦�ԂȂ��������K�v�ł���B�l�ɂ����Ă͐H��Q�`�R���Ԃ͐H�����̏����z�����ꂽ�O���R�[�X���A�����Ŋ̑��ɂ����ăO���R�[�Q�������ɂ�萶�����ꂽ�O���R�[�X����v�ȋ������ƂȂ�B����ɐ�H�������Ɠ��V������ȃO���R�[�X�̋������ƂȂ�A��Ӑ�H��ł͊̑����狟�������35�`60�����A60���Ԑ�H��ł�95���ȏオ���V���ɂ��B���V���ōł��d�v�Ȋ�͓��_�ł���A�ؓ��A�Ԍ����A�t�����Ȃǂ̖����g�D�ŎY�����ꂽ���_�͌����ɂ��^��̑��Ŏ�荞�܂�A�s���r���_���o�ē��V���o�H�ɂ��A�O���R�[�X�֓]�������B���̃O���R�[�X�͍ēx�����g�D�ŗ��p������_�����������B���̊̑��Ɩ����g�D�̊Ԃ��O���R�[�X�����_����ă��T�C�N������ߒ����R����H�ƌĂԁB���ɕK�v�Ȋ�̓A�~�m�_�A�Ƃ�킯�A���j���ł���B�ؓ��ŎY�����ꂽ�A���j���͌����ɂ��^��̑��Ɏ�荞�܂�A�A�~�m��]�ڔ����ɂ��s���r���_�ƂȂ�A���V���o�H�ɂ��O���R�[�X�ɓ]�������B���̃O���R�[�X�͋ؓ��ōēx���p����A�s���r���_�ƂȂ�A���ꂪ�A�~�m��]�ڔ����ɂ��A���j���ƂȂ�B���Ȃ킿�R����H�Ɠ��l�̃O���R�[�X�]�A���j����H���̑��Ƌؓ��̊Ԃʼn��肳��Ă���B������̊�͎��b�g�D�ł̑�ӎY���ł���O���Z���[���ŁA�̑��Ɛt���ɑ��݂���O���Z���L�i�[�[�ɂ��O���Z���[��3-�����_�֓]������A���̌�_������ăW�q�h���L�V�A�Z�g�������_�ƂȂ�A���V���o�H�̏I���̒i�K���o�āA�O���R�[�X�֓]�������B���V���o�H�ɂ͉t�I�o�H����������P�ɉn�̋t�����ł͂Ȃ��B
![]()
�����w���|�[�g�Q
�i�w���̍D�ӂɂ��f�ځj
�P�D �h�{���i�����A�����A�^���p�N���j�́A���̃G�l���M�[�iATP�j�ɕϊ����ꗘ�p����Ă���B���̑�ӌo�H�̊T�v��}�����Ď����AATP�̐����ߒ��ɂ��Đ�������B���̍ہA��ӏ�ŏd�v�ȃ|�C���g�ƂȂ鉻�����̍\����}���ɋL�����Ȃ����B

�@��X���̓��Ɏ�荞�h�{���͂��̂܂܃G�l���M�[�Ƃ��ė��p�����̂ł͂Ȃ��A��������邱�Ƃł͂��߂Đ��̂ɂƂ��ė��p�\�ȃG�l���M�[�iATP�j�ɕϊ������B���̉ߒ��́A�@��ɒ��œ����A�^���p�N���A�������A���ꂼ��O���R�[�X�A�A�~�m�_�A���b�_+�O���Z���[���Ȃǂ̒P���ȍ\�������ɂ܂ŕ������������A�A�����̕������ꂽ�������זE���ł���ɕ�������A�A�Z�`��-CoA�Ȃǂ̂悤�ȋ��ʂ̒ᕪ�q�����ɂȂ�TCA��H�ɂ����Ċ��S�ɕ��������ى��A�B�~�g�R���h���A���ŁA�A�Z�`��-CoA�̃A�Z�`������S�ɕ�������邱�ƂȂǂŕ��o����鎩�R�G�l���M�[���A�_���I�����_���ɂ����ATP�����ɕϊ�����d�q�`�B�n�̂R�̒i�K����Ȃ�B
�@ �̂P�A�����̕���
�n
�@�O���R�[�X�����C�I�ɓ��_�ɕ��������Ӊߒ��B�O���R�[�X�P���q�̕����ɂ����_�Q���q���邪�A����ɔ����ĂQ���q��ADP�ƃI���g�����_(Pi)����Q���q��ATP����������B���C�I�������ɂ����鐶�̂̃G�l���M�[�l�������̂����Ƃ���v�Ȃ��̂ŁA���Ƃ��Γ����̋ؓ��̎�v�G�l���M�[���ł���B�L�`�ɂ́A�͋ɂ߂đ����̐����ɂ�铯�o�H�ɂ�铜�̕����A���Ȃ킿���C���������ɂ���X�̔��y�⌙�C�I�ȓ������̃s���r���_�����܂ł̕������܂ށB��҂ł̓s���r���_�͒E���f����ăA�Z�`��CoA�ɂȂ�N�G���_��H�ɓ��邱�Ƃɂ���ē�_���Y�f�܂Ŏ_������邪�A���̂Ƃ��Ő��������̂��܂߂āA�ċz���ɂ���Ď_������邱�ƂɂȂ�B�n�y�f�͂��זE���t�����ɑ��݂��A�����ʼn��s����B
�@�ATCA��H
����т��̑��̈ى���p�ɂ���Đ������A�Z�`��CoA�����S�ɐ��Ɠ�_���Y�f�ɕ�������_���I�ߒ��ł���B���̉�H�Ő�����NADH�AFAD�Ҍ��^�͌ċz���ɂ���ĕ��q��y�f�Ŏ_������A���E�A�~�m�_�E���b�_�̊��S�ȕ����ƍő�̃G�l���M�[�̈����o�����\�ɂȂ�B�N�G���_��H�̑��̐����I�����͐��̍\�������̍����Ɍ������������邱�ƂŁA��-�P�g�O���^���_�̓O���^�~���_�A�X�N�V�j��CoA�̓|���t�B�����A�I�L�T���|�_�̓A�X�p���M���_��w�L�\�[�X�A�Ȃǂ̍����̏o�������ƂȂ��Ă���B�N�G���_��H�̓~�g�R���h���A���̗n�������i�~�g�R���h���A�}�g���N�X�j�ɋǍ݂��邪�A�D�C���ۂł͖��n�ɑ��݂���B�N�G���_��H���P��]����ƃA�Z�`����P�����S�_�������B
�@�B�d�q�`�B�n
�@�⎉�b�_�̎_���A�N�G���_��H�Ő�������NADH��FADH2�́A���̕��q�Ɉڂ�₷���d�q���܂ލ��G�l���M�[���q�ł���B�����̓d�q���y�f�Ɉڂ�ƁA���ʂ̎��R�G�l���M�[�����o����A���̃G�l���M�[��ATP�����Ɏg����B�_���I�����_���Ƃ́A��A�̓d�q�`�B�n�ɂ��NADH��FADH2����O2�֓d�q���n����A���̌���ATP�����������ߒ��������B���̉ߒ��͍D�C�������̎�v��ATP�������ƂȂ��Ă���B �@�_���I�����_���̍\���͔��ɕ��G�ł���B�~�g�R���h���A�����̃^���p�N�����̂�ʂ��ēd�q��NADH��FADH2����O2�֗���A���̍ۂɃ~�g�R���h���A�̃}�g���N�X����O�փv���g�������ݏo�����B���ʂƂ��āApH���z�Ɩ��̗����̓d�ʍ��ɂ��v���g���쓮�͂����ݏo����AATP�̓v���g�����y�f�����̂��o�R���ă~�g�R���h���A�̃}�g���N�X���ɖ߂�ۂɍ����B���̂悤�Ɏ_���ƃ����_���́A�~�g�R���h���A����������v���g�����z�ɂ���ċ������Ă���B �_���I�����_���ɂ����ēd�q�쓮�͂̓v���g���쓮�͂ɕϊ�����A���Ƀ����_���\�ւƕς��B�_���I�����_���̑�P�i�K�́A�d�q���쓮����R�̃v���g���|���v�A�܂�NADH-Q�Ҍ��y�f�A�`�g�N�����Ҍ��y�f�A�`�g�N�����_���y�f�ɂ���čs����B�����̑傫�Ȗ��ђʌ^�����̂́A�t���r���A�L�m���A�S�|�����N���X�^�[�A�w���A���C�I���Ƃ����������̎_���I�����_�����S���܂�ł���B�_���I�����_���̑�Q�i�K�́AATP�����y�f���i�߂�B���̍y�f�́A�~�g�R���h���A�̃}�g���N�X���ɖ߂�v���g���̗��ꂪ�������AATP�����̂��߂̏W���̂ł���B
�@ �̂Q�A�A�A�����̕���
�H�����瓾���鎉���́A�_�`���X�t�ɂɂ���ăO���Z���[���Ǝ��b�_�ɕ�������A��������z������喬����̑��֒��ډ^�����̂����邪�A�قƂ�ǂ͒��̏��זE�Ńg���O���Z���h�ɍč�������R���X�e���[����������Ƌ��ɐÖ��ɓ���B���̌㌌���ŕ�������e�g�D�ɑ��荞�܂ꂻ�ꂼ�ꓭ���B���b�_�͊̑��ő�ӂ��ăA�Z�`��CoA�ƂȂ��Ăs�b�`�T�C�N���ɓ�����CO2��H2O�ɕ������ꍂ�G�l���M�[����o����B
�@�̂R�A�A�A�^���p�N���̕���
�H������ێ悵���^���p�N���́A���̂̏����ǂ̒��Ńv���e�A�[�[�̍�p�ɂ���ĉ�����������ŏI�I�ɂ̓A�~�m�_�ɂȂ�B �A�~�m�_�́A��-�A�~�m���������A�c�����Y�f���i�͎�v�ȑ�ӎY���ɕϊ������B�ߏ�ȃA�~�m�_�̃A�~�m��͑啔�����A�f�ɕϊ�����邪�A�Y�f���i�̓A�Z�`��CoA��A�Z�g�A�Z�`��CoA�A�s���r���_�A���邢�̓N�G���_��H�̒��ԑ̂̂ǂꂩ�ɕϊ������B�]���Ď��b�_��P�g���́A�O���R�[�X�̓A�~�m�_���琶���ł���B
�@
�Q�D �^�j������(A) ��`�q�̕����A(B)��`�q�̓]�ʂƖ|��ɂ��Đ�������B
(A) ��`�q�̕���
��`�q�̖{�̂�DNA�ł��邪�A���̕����l���͔��ۑ��I�����ƌĂ�Ă���B�����2�{��DNA��1�{���𒒌^�Ƃ��đ���I������`������邱�ƂŁA�K�R�I�ɂ��Ƃ̉���z��Ɠ������̂��e�Ղɓ����镡���l���ł���BDNA�̕����͐��F�̂̂������̕����N�_����n�܂�A��������i�s����BDNA�����ɂ͎O�̖��m�Ȓi�K������B
�@�@ �����^���p�N����DNA�����̋N�_�ɐ������W�����邱�Ƃŕ������J�n����B
�@�A ���L���̒i�K�ŁA�����̂���k�N���I�`�h��L������DNA���Ɏ�荞�ޔ�����G�}����B�����DNA�͔��ۑ��I�ɕ��������B
�@�B �Ō�͕����I���ŁA�^���p�N���������u����������A�����炵DNA���q����������B
�@�@�@�咰�ې��F�̂̕����N�_����Ȃ̂ɑ��A�^�j�����̐��F�̂ł�DNA�����J�n�̕��ʂ�����������B�^�j�����ɂ����Ă͕����t�H�[�N�̈ړ����ۂ��x�����A�^�j������DNA�ɐ������̓Ɨ��̕����N�_�����݂����̕����N�_��20�`80�̏W�c�i�����P�ʁj�Ƃ��Ċ����������X���ɂ���AS���̊Ԓ��A�����炵�������P�ʂ����������ꂷ�ׂĂ�DNA�̕������I���܂ő����̂ŁA�܂葽���̕����t�H�[�N�����F�̏�œƗ��ɓ������ߑ傫�Ȑ^�j�����Q�m���ł����j�����̃Q�m���Ƃقړ������Ԃŕ������s����B
�@�@�ADNA�̐V���̍����́A�L�������鍽�̖��[�Ƀk�N���I�`�h�����X�ƕt�����邱�Ƃɂ���Ă���B���̏d��������DNA�|�������[�[�ƌĂ��y�f�ɂ���ĐG�}�����B
�^�j�����i�M���ށj�ł́ADNA�|�������[�[���A���A���A�ЂȂǂ��m���Ă���BDNA�|�������[�[�͂T�f���R�f�̕�����DNA����L����������������B�c�m�`�|�������[�[�������t�H�[�N�œ������߂ɂ́C�c�m�`��d�����w���J�[�[�ŊJ�ꂽ��C�P�{���c�m�`�𒒌^�Ƃ��āC�܂��J�n��(RNA�@primer(�Œ�4�`5�̉��))�����������K�v������B���̃v���C�}�[����_�ƂȂ��ď��߂Ăc�m�`�|�������[�[�������C�V�����c�m�`���i�V�����j��L�������Ă����B�v���C�}�[�͖�ڂ��I����Ə��������B�������C���^�ƂȂ�e�c�m�`���̕������́C�����t�H�[�N�̐i�s�����ɑ��āC������R�f
���T�f�ŁC�������T�f���R�f�Ƌt�ɂȂ��Ă���B�]���āC�V�����̕������́C�O�҂��T�f���R�f�ŁC��҂��R�f���T�f�ɂȂ�B�Ƃ��낪�c�m�`�|�������[�[�͂T�f���R�f�̕��������ɍ���L��������y�f�Ȃ̂ŁC�T�f���R�f�̐V�����͘A���I�ɒ��ł��邪�C�R�f���T�f�̐V�����͘A�����ĐL���ł��Ȃ��B����ŁC�V�����̕������@�́C�A���I�����ƕs�A���I����(����t���O�����g�̉���)�ɂ킯����B
�A���I�����F�@�w���J�[�[�iDNA������{���ɕ�������y�f�j�ɂ���Ĉ�{���ƂȂ���DNA���̂����A�R�f ���T�f���𒒌^�ɂ��č����V���i�T�f���R�f�j�ł�DNA�|�������[�[�ɂ��L�������������t�H�[�N�̐i�s�����Ɠ���ŁADNA�|�������[�[�Ђɂ���ĘA���I�ɕ�������Ă����B���̐V�����̓��[�f�B���O���ƌĂ��B
�s�A���I�����F��������̂T�f���R�f���𒒌^�ɍ��������DNA���͂R�f���T�f�����ɂȂ邪�C���̕����ɍ���L�������镡���y�f�͂Ȃ��B�����ŁC�c�m�`�|�������[�[���C�����t�H�[�N�̐i�s�ɋt����āC�T�f���R�f�����ɍ���L�������邱�ƂɂȂ�B���̂��߁C�V�����̐L���͓r���Œ��f����C�Z���c�m�`�����s�A��(����t���O�����g)�ɍ��������B���̌�C�Z���c�m�`�����A������āC�V��������������B���̐V���������M���O���i�x�����j�Ƃ����B�ȉ��́C���M���O���̏ڂ����`���ߒ��ł���
�@�@�w���J�[�[�ŕ������ꂽ�T�f���R�f���͌����^���p�N���ŕ⋭����C����ȏ�ԂɂȂ�B
�A�@�v���C�}�[�[�ɂ��C�܂��C�v���C�}�[���T�f���R�f�����ɍ��������B
�B�@���̃v���C�}�[�ɑ����āC�c�m�`�|�������[�[���ɂ��C�V�������T�f���R�f�����ɍ�������n�߂�B�������C��ɍ����J�n�_�ƂȂ����v���C�}�[�̕��ʂ܂ł����L���ł��Ȃ��B���̂悤�ɂ��Ăł����V�����̒f�Ђ͉���t���O�����g�ƌĂ��B
�C ����t���O�����g�̌`�����I������ƁC�ʂ̂c�m�`�|�������[�[�ɂ��C��̃v���C�}�[����������Ăc�m�`���ɒu����������B
�D �Ō�ɁC�c�m�`���K�[�[�ɂ��C����t���O�����g���C�Œu��������ꂽ�c�m�`�����A�������B
�E �ȏ�̔����̌J��Ԃ��ɂ���āC�P�{�̘A�������V�����i�S�̓I�ɂ͂T�f���R�f�j�ɂȂ�C��������������B�@�@
�iB�j�@��`�q�̓]�ʂƖ|��@
�@�]�ʁF�@
DNA����RNA����������i�K��]�ʂƂ����BRNA��DNA���𒒌^�Ƃ��č����B�B�^�j�זE�ł��]�ʈ��q����`�q�̏㗬���G���n���T�̈��Ɍ������C�����ɁC�v�����[�^�[��ǂݎ�邱�Ƃɂ���ē]�ʂ��J�n�����DNA�̒��^���̉���z���ǂݎ���đ���I��RNA���������锽���i�]�ʁj��G�}���钆�S�ƂȂ�y�f��RNA�|�������[�[�Ƃ����B�k�N���I�`�h���̍������@��DNA�|�������[�[�̏ꍇ�Ǝ��Ă��邪�CRNA�|�������[�[���v���C�}�[��K�v�Ƃ��Ȃ��B�^�j�����ɂ�3��ނ�RNA�|�������[�[�iI,II,III�j�����݂��A���̂���RNA�|�������[�[II��mRNA�̓]�ʂ��s���BRNA�|�������[�[II�͏��Ȃ��Ƃ�10��ނ̃T�u���j�b�g�������A���܂��܂Ȓ��߈��q�ƌ������ċ���ȕ����́i�z���y�f�j���`������B�������A����炾���ł͓]�ʂ��J�n�ł��Ȃ��B�����̍y�f�́A���ꂼ��قȂ�v�����[�^�[��F��������q�Q�ƌ���������{�]�ʈ��q�i�y�f�����́j���`������B
RNA�|�������[�[�T�F�j���̂ɑ��݁B�P�WS�A�T�D�WS�A�Q�WS rRNA�O��̂���������B
RNA�|�������[�[�U�F�j���ɑ��݁BmRNA�O��́i����RNA�j�̍�����G�}����B
RNA�|�������[�[III�F�@�j���ɑ��݁B����RNA,tRNA�ƂTS rRNA�̍�����G�}����B
�^�j�זE�̃Q�m��DNA�ɂ̓^���p�N���ɖ|��Ȃ�����z���݂���B���̂悤�Ȕz���̂܂ʂ��Ƃ��Đ�����RNA�ihnRNA�Ƃ����j�ɂ̓^���p�N���̈ꎟ�\���ɑΉ����Ȃ��z���݂��邱�ƂɂȂ�B���̂悤�Ȕ�R�[�h�̈���C���g�����ƌĂԁBhnRNA�̃C���g���������͌�Ő�̂Ă��顈���C�]�ʂ���Ă�mRNA�Ƃ��Ďc�镔�����G�L�\���Ƃ����B�^�j�זE�̑����̃^���p�N����`�q�̃G�N�\���̓C���g�����ɂ���ĕ��f����Ă���i�C���g�����͏��GU�Ŏn�܂�CAG�ŏI���j�B
RNA�|�������[�[II�ɂ��j�œ]�ʂ��ꂽmRNA�̑O��́ihnRNA�j�́A����3�̉ߒ����o��mRNA�ɂȂ�B�j���ɂ����邱��3�̉ߒ����v���Z�V���O�Ƃ����B
�@ 5'���[�ɃL���b�v�\������
�A 3'���[���|���i�`�j������
�B �C���g�����������藣�����i�X�v���C�V���O�j
�@�@�]�ʂ̊J�n�ƂƂ��ɍs����B�z�X�z�q�h���^�[�[�A�O�A�j���g�����X�t�F���[�[�A�Q������`���g�����X�t�F���[�[�����̔����Ɋ֗^����B�^�j�זE�ɂ����āA�L���b�v�\���͖|��̊J�n�M���ƂȂ�B
�A �|��(A)�t���M��(AAUAAA)�Ŏw�߂���A�|��(A)�|�������[�[�ƕ����̈��q�ɂ�荇�������B�|��(A)����mRNA�̈��萫��|����������߂�B�|��(A)���̒����͈�`�q�ɂ��قȂ�A50�`250�����ł���B
�B snRNA�����U�̃^���p�N�� (U1-U6)���C���g���������𐳊m�ɐ藣���C�G�N�\����A�����顂��̔����͉��������ł͂Ȃ��G�X�e�����������𗘗p����̂ŁC�G�l���M�[��K�v�Ƃ��Ȃ��B
�A�|��F
�@
mRNA�𒒌^�Ƃ��ă^���p�N����������i�K��|��(translation)�Ƃ����B�^���p�N���̐������ɂ�mRNA�ȊO�ɁA�g�����X�t�@�[RNA(tRNA)��{�\�[�����K�v�ł���B
(1) �A�~�m�_�̊�����
�@ �A�~�m�_�����ٓI��tRNA��2'�܂���3' ���[�ɃG�X�e����������B�J�n�R�h���iAUG�j �ɑΉ�����J�ntRNA�itRNAfMet�j�ɂ̓��`�I�j��-tRNA����������B
(2) �J�n�����̂̌`��
�@�͂��߂�Met-tRNAMet�eIF��GTP�Ƃ�����������A40S�T�u���j�b�g�ƕ������A������L���b�v�����^���p�N���iCBP�AeIF-4�j��40S�J�n���������`������iCBP�͑��̃^���p�N�����q�ƈꏏ�ɁA�^�j������mRNA��5�f���[7-���`���O�A�j���_�L���b�v�ɓ��ٓI�ɑ��ݍ�p����j�B����40S�J�n�����̂�mRNA�ɉ�����5�f��3�f�����ɊJ�n�R�h���ɓ��B����܂ňړ�����B�J�n�R�h����������ƁA���{�\�[�����T�u���j�b�g��Met-tRNAiMet��P���ʂŊJ�n�R�h���Ƒ��ݍ�p�ł���悤�Ȉʒu���Ƃ�B �܂����̒i�K��ATP�̉����������s���A����eIF2�ƌ�������GTP��eIF5�������������邱�Ƃ���������60S�T�u���j�b�g�������A80S�^���p�N���������̂������B�^���p�N���������J�n����B�����̌`����A�𗣂����J�n���q�͎��̊J�n�����̌`���ɗp�����A1�{��mRNA�ɂ͊���̃��{�\�[�������̂��`������A�|���\�[�����`������B
(3) �|���y�v�`�h���̉���
�y�v�`�h���̉����ł́A�A�~�m�_��1����N���[����C���[�̕����ɂȂ���B���̃^���p�N���������q(EF)���֗^���AGTP�̉�������������ɋ�������B�����T�C�N���ɂ́AmRNA�̎��̃R�h�����w�肷��A�~�m�_�����������A�~�m�A�V��-tRNA��A���ʂɂ����ƂŎn�܂�B�������̉ߒ��ł́A3�i�K�̏��T�C�N���ɂ���āA�����ƃA�~�m�_�����т����̃|���y�v�`�h���ɕt������B
�@ �������A�~�m�A�V��tRNA�����{�\�[�������̂�A���ʂɈʒu����B
�A �y�v�`�h�������`������
�B ���{�\�[���ɑ�1�R�h������mRNA�����B
�ŏ��̍����������̏��T�C�N���ł́A�J�n����80S���{�\�[��A���ʂ͋�ŁAP���ʂ̓A�~�m�_�����̊J�ntRNA����߂Ă���B���ꂼ��̏��T�C�N���̏I���ɂ́AP���ʂ�tRNA���q�ɕt�������A�~�m�_�c��̐���1����������B�܂�EF-Tu�EGTP�̓A�~�m�A�V��tRNA�ƌ������ĎO�A�����̂��`�����A���{�\�[����A���ʂɂ͂܂荞�ށB�A�~�m�A�V��tRNA�̃A���`�R�h����A���ʂ�mRNA�̃R�h���Ƃ̊Ԃɐ�����������ł���ƁA�����͈̂��艻�����B�����EF-Tu�EGTP�����{�\�[����̌������ʂ���сAP���ʏ��tRNA�ƐڐG�ł���悤�ɂȂ�B���̐ڐG���������ƂȂ���GTP��GDP��Pi�ɉ�����������AEF-Tu�EGDP�̃R���z���[�V�������ω����āA�������Ă����A�~�m�A�V��tRNA���𗣂���B
�@�זE���ɂ���قƂ�ǂ��ׂẴA�~�m�A�V��tRNA���q�͎O�A�����̂Ƃ��đ��݂��Ă���BEF-Tu�EGTP�����̂�tRNA���q�̎O���\���ɋ��ʂ̓�����F�����āAfMET-tRNAfMet�ȊO�̂��ׂẴA�~�m�A�V��tRNA���q�Ɍł���������B�����fMET-tRNAfMet�͓����I�ȓ\���ɂ���āA���̑����ׂẴA�~�m�A�V��tRNA���q���环�ʂ����BF-Tu�EGTP�A�~�m�A�V��tRNA�O�A�����̂̓��{�\�[��A���ʂɎ��R�ɓ��荞�ނ��Ƃ��ł���B
(4)
�������̏I���i���I���j
mRNA�̃R�h����UAG,UAA,UGA�̏ꏊ�ɂ���Ƃ����̃R�h���A�~�m�_���Ή������A�Ή�����A�~�m�V��-tRNA�����݂��Ȃ��B����ƏI�����q(eRF)�������ăy�v�`�h��tRNA�̊Ԃ̌������ؒf����A�y�v�`�h�����{�\�[������V������B�V�������y�v�`�h���̃z���~������͂����^���p�N��������������B�^�j�����ł�eRF���S�I�~�R�h����F������B
�R�D �ȉ��̌����������B
�P�D �A�m�}�[
���n�t���ł�5�ȏ�̒Y�f�����A���h�[�X��6�ȏ�̒Y�f�����P�g�[�X�́A���q���փ~�A�Z�^�[�������ɂ����Fisher�̓��e���̂悤�Ȓ����\���ł͂Ȃ���\�����Ƃ�B���̍ہA�V���ɕs�ĒY�f�������邽�߂Q��ނ̗��ِ̈��̂��ł��A�����ِ��̂��A�m�}�[�Ƃ����B�V���ɐ������s�ĒY�f�i��ɂȂ����P���ł�����_������Ă���Y�f�i��̎_�f���q�ƌ������Ă���j�j���A�m�}�[�Y�f�ƌĂсA�A�m�}�[�Y�f�ɁA���ꂩ�炩�炢�����s�ĒY�f�ɂ��Ă��鐅�_��Ɠ��������Ƀq�h���L�V����������Ă�����A�m�}�[�A���̋t�̏ꍇ�̓��A�m�}�[�Ƃ�ԁB�P���̓�-����-D�s���m�[�X�̌`�ŕ`����邱�Ƃ��������A�Y�f5���邢��6�̓��̃A�m�}�[�́A���t��Ԃő��݂��Ă���B
�Q�D�փ~�A�Z�^�[��
�A���f�q�h��ƃA���R�[����OH��ԂŌ`�������G�[�e�������̈����A�փ~�A�Z�^�[�������Ƃ����A���̂悤�Ȍ��������������w�~�A�Z�^�[���Ƃ����B�`�����ꂽ�w�~�A�Z�^�[����̒Y�f���A�m�����b�N�Y�f�AOH����A�m�}�[�q�h���L�V����Ƃ�ԁB
�v
�R�D���{�]�[��
�@rRNA,�^���p�N������Ȃ�A�זE�������ER�i���E�́j�ɂ��������ŁA��Ƀ^���p�N������������B���̑��ݏ�Ԃ�莟��2�ʂ�Ɍ^�킯�����B
�@�������^�iER�ɕt���j�@m-RNA�̐�[���ɂ���Č`�������A�~�m�_�z��i�V�O�i�����j�����{�]�[������o���Ƃ��ɁA���̃V�O�i��������̂ƂȂ��āA���{�\�[�������E�̖��ɗU������g�ʏ��E�̂ƂȂ�B���̃��{�]�[�����g���g���̂ł͂Ȃ��A����^���p�N���Ƃ��ă^���p�N������������B
�A�V���^�i�זE���ɎU����Ă���j�@m-RNA�ɃV�O�i�����ɑΉ����鉖��z���݂����A�P�ƂŃ^���p�N�������������g�ł�����g���B
�S�D �J���j�`��
�\�����͎��̂Ƃ���B
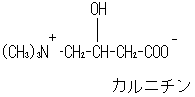
������ӂɂ����Ď��b�_�̓~�g�R���h���A���ɗA�������܂ł̓G�l���M�[�����ɗp����ꂸ�A�܂��A�V��CoA�̓~�g�R���h���A������ʉ߂ł��Ȃ��̂ŁA�J���j�`���ƌ������邱�Ƃœ�����ʉ߂ł���A�V���J���j�`���ƂȂ�B�܂�J���j�`���́A�����ʉ߂̂��߂Ɉꎞ�I�ɃA�V��CoA �̑�����ʂ����S�́A���b�_�̃L�����A�[�Ƃ��Ă͂��炢�Ă�B
�T�DNAD
�@ 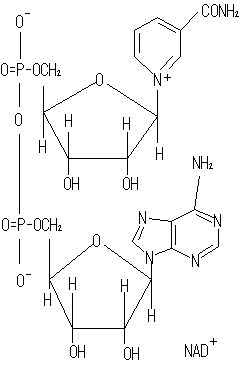 NAD+�̐������̂̓j�R�`���A�~�h�A�f�j���W�k�N���I�`�h(nicotinamide adenine dinucleotide)�ŁA��y�f�̈��ł���B�e��̒E���f�y�f�ɂ�����琅�f���q�P�Ɠd�q�P�����A�Ҍ��^�ɂȂ�iNAD�̎_���^��NAD+,�Ҍ��^��NADH�j�@�B
NAD+�̐������̂̓j�R�`���A�~�h�A�f�j���W�k�N���I�`�h(nicotinamide adenine dinucleotide)�ŁA��y�f�̈��ł���B�e��̒E���f�y�f�ɂ�����琅�f���q�P�Ɠd�q�P�����A�Ҍ��^�ɂȂ�iNAD�̎_���^��NAD+,�Ҍ��^��NADH�j�@�B
�U�DFAD
FAD�̐������̂̓t���r���A�f�j���W�k�N���I�`�h�@(flavin adenine dinucleotide)�ł���B���{�t���r���ƂQ�̃����_��ƃA�f�m�V������Ȃ�W�k�N���I�`�h�B�D�C�������ɂ����C�������ɂ��L�����z���AFMN�Ɠ��l�ɐ��̎_���ɂ�����d�q�`�B�ɏd�v�Ȗ������ʂ����Ă���B���Ȃ킿�t���r���y�f�Q�̕�y�f�Ƃ��ē����A�����d�q��e�̂ւ̓d�q�̓`�B�Ɋ֗^����B
�V�D�Z���g�����h�O�}
�@��`�q���̖{�̂ł���DNA�����^�ƂȂ��đ���I��RNA���q�̂̍������s���i�]�ʁj�A���ɂ���RNA���q���^���p�N�������̉ߒ��i�|��j�ŃA�~�m�_�z������߂邽�߂̒��^�ƂȂ�A�Ƃ�������A�̈�`���̗���ɂ��Ă̊�{�T�O�B
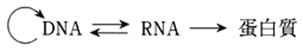
���q�����w�̃Z���g�����h�O�}���͈�`���̗���������DDNA�ɑ��݂����`������̍ۂ�DNA�ցi�~�`���j�C��`�q�����ł�RNA�Ɉڂ���C���̏��ɏ]���Ē`�������ł��邱�ƁC�܂��C�`�����ɗ��ꍞ���͌����Ċj�_���iDNA��RNA�j�ɋt�����Ȃ����Ƃ������Ă���
�W�D�G�L�\���ƃC���g����
�@�^�j�����ł́ADNA���RNA�ɓ]�ʂ����̈�̒��Ɏ��ۂɖ|���̈�̃G�L�\���Ɣ�|��̈�̃C���g����������B�]�ʏI����̖����nRNA�́A�j�ɂ���ԂɃX�v���C�V���O�ɂ��C���g��������o����āA�G�L�\�������������悭�Ȃ����������nmRNA��������B����͐^�j�זE�̊j�ɑ��݂���X�v���C�\�\�[����ł����Ȃ���B
�X�D�K�{���b�_
�l�͑̓��œ����E����ς����E���b���玉�b�_����邱�Ƃ��o���邪�A�̂ɂƂ��ĕK�v������ǂ��A�̓��ō��Ȃ����b�_������B�����K�{���b�_�ƌĂԁB���m�[���_�E���m�����_�E�A���L�h���_���̕s�O�a���b�_�������ŁA����͐A�����̖����⋛���ɑ����܂܂�Ă���B
�K�{���b�_�́A�����̑�ӂɂ���ăv���X�^�O�����W���ɓ]������B�������̎�ނ�����A�g�̂ɑ��鎟�̂悤�Ȃ̐���������p�����B
�E�����~���@�@�@�@�E�����ÏW�}���@�@�@�@�E�����k
�E�C�ǎx���k�@�@�@�E���ǔ����Ɋ֗^�@�@�@�@�E�����ÏW����
�E�q�{�ւ̍�p�@�@�E���NJg���@�@�@�@�@�@�@�E���b�g�D�ł̎��b�_�V���}���A���S
�E�ݎ_����}��
�P�O�D�K�{�A�~�m�_
�@�������\������^���p�N����20��ނ̃A�~�m�_����Ȃ��Ă��邪�A�����̂��������̑̓��ł͍�������Ȃ����̂�����B���ꂪ�K�{�A�~�m�_�ł���B���l�͉���8��̃A�~�m�_�C�������̗c���ł͉����ăA���M�j�����͂���B
�@�A�~�m�_���@�@�@�@�@3�@�@1�����@ �@�@R
|
�o���� |
�u���� |
�u |
|
|
���C�V�� |
�k���� |
�k |
|
|
�C�\���C�V�� |
�h���� |
�h |
|
|
�X���I�j�� |
�s���� |
�s |
|
|
���`�I�j�� |
�l���� |
�l |
|
|
�t�F�j���A���j�� |
�o���� |
�e |
|
|
�g���v�g�t�@�� |
�s���� |
�v |
|
|
���W�� |
�k���� |
�j |
|
|
�A���M�j�� |
�`���� |
�q |
|
![]()
�����w���|�[�g3
��X���̓��Ɏ�荞�h�{���͂��̂܂܃G�l���M�[�Ƃ��ė��p�����̂ł͂Ȃ��A��������邱�Ƃł͂��߂Đ��̂ɂƂ��ė��p�\�ȃG�l���M�[�iATP�j�ɕϊ������B���̉ߒ��́A�@��ɒ��œ����A�^���p�N���A�������A���ꂼ��O���R�[�X�A�A�~�m�_�A���b�_+�O���Z���[���Ȃǂ̒P���ȍ\�������ɂ܂ŕ������������A�A�����̕������ꂽ�������זE���ł���ɕ�������A�A�Z�`��-CoA�Ȃǂ̂悤�ȋ��ʂ̒ᕪ�q�����ɂȂ�TCA��H�ɂ����Ċ��S�ɕ��������ى��A�B�~�g�R���h���A���ŁA�A�Z�`��-CoA�̃A�Z�`������S�ɕ�������邱�ƂȂǂŕ��o����鎩�R�G�l���M�[���A�_���I�����_���ɂ����ATP�����ɕϊ�����d�q�`�B�n�̂R�̒i�K����Ȃ�B
![]()
�������w�ۑ背�|�[�g�S
�������Ǝ����̉��w��
�R.�������̖������A�Ô������������B�܂��A�������_���ɂ��Đ�������B
�������͑傫���S�̔����n�ɕ����邱�Ƃ��ł���B
�@���̋z���F�`���R�C�h���̖��^���p�N���Ɍ����������̋z���ł���B�N�����t�B���̓w���Ɏ��������ł��邪�A���S�ɂ͂l��2�{������A�������̂T���ȊO�ɂ����P�T��������B�z�����ꂽ���G�l���M�[�ɂ���āA�܂��d�q���^�́i�ΐF�A���̏ꍇ�͐��j���疳�����d�q��D���A�_�f��������B
�@�@�@�@2�g2�n���n2�{4�g�{�{4���|
�@�@�����ēd�q�͈ꎟ��e�̂ɂ킽�����B���̔����͑S�ă`���R�C�h���ɂ�������w�n�iphoto system�j�ƌĂ��^���p�N�������̂ōs����B
�A�d�q�`�B�F�d�q�̓`���R�C�h���ɂ���l�X�ȓd�q�`�B�������o�čŏI�I�ȓd�q��e�̒ʏ�͂m�`�c�o�{�ɓn����āA������Ҍ����Ăm�`�c�o�g�Ƃ���B�d�q�̈ړ��Ƌ������Đ��f�C�I�����X�g���}����`���R�C�h���o�֗A�������B���̌��ʃ`���R�C�h��������Ő��f�C�I���Z�x���z���`�������B
��1�2�i�K�̉��w�������܂Ƃ߂��
�@2�g2�n�{2�m�`�c�o�{��2�g�{�{2�m�`�c�o�g�{�n2 �@�ƂȂ�B
�@�@�N�����t�B���̕��q�\��
�B�`�s�o�̐����F���f�C�I���Z�x���z�ɏ]���Đ��f�C�I���̓`���R�C�h���o����X�g���}�֗A���^���p�N���̕����̒����ړ�����B�b�e�O�b�e�P�����̂͐��f�C�I���̈ړ��Ƌ������Ă`�c�o�Ƃo������`�s�o������B�i�o���͖��@�����_�g�o�n�S2�| �j
�@�@�@�@�@�g�{�{�`�c�o�R���{�oi2-���`�s�o�S�|�{�g2?�n
�C��_���Y�f�̌Œ�F�������̑�Q�i�K�Ƒ�R�i�K�Ő������ꂽ�m�`�c�o�g�Ƃ`�s�o�S�|�̃G�l���M�[�𗘗p�����b�n2�Ƃg�Q�n����U�P�����������B
�@�@�@ �@�@6CO2�{18ATP4�|�{12NADPH�{12H2O���b6�g12�n6�{18ADP3�|�{18Pi2�|�@�@�@�{12NADP�{�{6�g�{
�@�@�`�B�܂ł̔����͑S�ă`���R�C�h���̃^���p�N���ɂ���Đi�߂��A���ڌ��G�l���M�[�Ɉˑ����Ă��邽�ߖ������ƌĂ��B
�C�̔����͗t�Α̂̃X�g���}�n���敪�ɑ��݂���y�f�ɂ���čs���A���ڂɂ͌��̃G�l���M�[�Ɉˑ����Ă��Ȃ����߁A�Ô����ƌĂ��B
�n�iglycolytic pathway�j�Ɗ���x���̃����_��
�O���R�[�X��ӂ̍ŏ��̒i�K�ł���ŃO���R�[�X�P���q�͂R�Y�f�������̃s���r���_�b3�g3�n3�\2���q�ɕς�����B�����̔������n�ƌĂсA���̉��w�����͍זE���]�����ŋN����A���q��_�f�Ƃ͊֗^���Ȃ��B�̍�p�͍��x�ɒ��߂���Ă��āA�זE���K�v�Ƃ���`�s�o�ɂ��傤�nj������O���R�[�X���זE���ɗA�������B���Ƃ̒Y�������ƍŏI�Y���̃s���r���_�̊Ԃ̑�Ӓ��ԑ̂̑S�ẮA�����_�������ł���B
�O���R�[�X��ӂ̏��������̑S�̂̎���
�@�@�@C6H12O6�{2NAD�{�{2ADP3�|�{2Pi2�|��2C3H4O3�{2NADH�{2ATP4�|�@�@�ƂȂ�B
�@NAD�{�ENADP�{
��i�K�ł̃����_���isubstrate-level phosphorylation �j
�@�זE���]�����ʼnn���y�f�ɂ���đ�ӕ������\���ω�����B���̃����_���ɂ͂Q����B���̑�P�̓O���Z���A���f�q�h�]�R�]�����_�f�q�h���Q�i�[�[�ƃz�X�z�O���Z�����_�L�i�[�[�ɂ���āA�G�}������̔����ɂ���Đ�����B��Q�̔����͔��G���S�������iexergonic reaction�j�ŁA�z�X�z�O���Z�����_�L�i�[�[�ɂ����ADP�ɓ]�ڂ���AATP�͐��������B�O�i�K�����Ńt���N�g�[�X�P,�U�]�r�X�����_�P���q�͂Q���q�O���Z���A���f�q�h�]�R�]�����_�������B�����ŃO���R�[�X�P���q�̕����͂Q���q��ATP���������ƂɂȂ�B
�T�DTCA�T�C�N���Ǝ_���I�����_��
�@TCA�T�C�N���itricarboxylic acid cycle�j
���̔����n�͂X�̔�������Ȃ�B�܂��A�Z�`��CoA�̒Y�f�Q�̃A�Z�`����S�Y�f�������̃I�L�T���|�_�ƌ������邱�Ƃ���n�܂�B�����P�̎Y���͒Y�f���q�U�̂�����ł���B�����Q�ƂR�ł͒P��̍y�f�A�R�j�^�[�[�ɂ���ăN�G���_�͒Y�f���q�U�̃C�\�N�G���_�Ɉِ��������B�����S�ł̓C�\�N�G���_�͒Y�f���q�T�̂Q�]�I�L�\�O���^���_�Ɏ_�������B���̂Ƃ��P���q��CO2����������A1���q��NAD�{��NADH�ɊҌ������B����5�ł�2�]�I�L�\�O���^���_�͒Y�f���q4�̃X�N�j�V��CoA�Ɏ_������A��2��CO2���A�܂�NAD�{��NADH�ɊҌ�����B�U�`9�܂ł̔����ŁA�X�N�j�V��CoA�̓I�L�T���|�_�Ɏ_������A�ŏ��̃A�Z�`��CoA�Ək������̂ɗp����ꂽ�̂Ɠ������q���Đ�����邱�ƂɂȂ�B������FAD��NAD�{�̊Ҍ����N����B�X�N�j�V��CoA���R�n�N�_�ɂȂ�Ƃ��i����6�j��GTP�̍�������������B
�@�@�@�@�@�@�@�@O�@
�@�@�@�@�@CH3�]C�]SCoA�{�RNAD�{�{FAD+GDP3�|�{Pi2�|�{2H2O
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@��
�@�@�@�@�@�@2CO2�{�RNADH+FADH2�{GTP4�|�{�QH�{�{HSCoA
�@�_���I�����_���ioxidative phosphorylation�j
�@�d�q�`�B�n�̎_���Ҍ������ɂ���ėV�������G�l���M�[��p����ADP�Ɩ��@�����_����ATP���������锽���B�^�j�זE���̃~�g�R���h���A�������邢�͌��j�זE�̌`�����ɂ����Č�����B���̔����@�\�͉��w�Z�������ʼn��肳�ꂽ�悤�ɁA�d�q�`�B�n�ɂ���Ė��̓��O�Ƀv���g���̓d�C���w�|�e���V���������`������A����𗘗p����ATP�����y�f��ATP����������B�h�{�f�̑啔���͍ŏI�I�ɂ�TCA�T�C�N���ł��̐��f��������Ƃ���NADH2�̌`�œd�q�`�B�`�ɓ`�����čy�f�Ŏ_�������B
�@�@�@�@�@�@�@H2O���d�q�`�B�n�i�V�g�N�����Ȃǁj��O2
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@��
�@�@�@�@�@�@�d�C���w�|�e���V�������iH�{�Z�x���z�{���d�ʁj
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@?
�@�@�@�@�@�@�@ADP�{Pi�\�\�\�\�\�\�\�\�\�\�\�\��ATP
�@�@�@�@�@�@�@�@�@���@�@�@�@ATP�����y�f�@�@�@�@�@?
�@�@�@�@�@�@�@�@�@�@ ���̂̊����i�؉^���E�����Ȃ��j�@�@�@�@�@�@�@�@�@�@
�U�D���b�_�̃��_���i�� oxidation�j
�@�@�@���b�_�̃��ʂ��_������A�Y�f���Q�̒P�ʂŎ��b�_�̒Y�f�����ؒf����锽���B
�@�@�@�~�g�R���h���A�ł͂܂��A�V��CoA���A�V��CoA�f�q�h���Q�i�[�[�ɂ��E���f�������N���A�����ăG�m�C��CoA�f�q�h���Q�i�[�[�ɂ��E���f�������A�����ăG�m�C��CoA�q�h���^�[�[�ɂ�鐅�t�������A3�|�q�h���L�V�A�V��CoA�f�q�h���Q�i�[�[�ɂ��E���f�����A3�|�P�g���A�V��CoA�`�I���[�[�ɂ��`�I�[���J�������ɂ���ăA�Z�`��CoA�ƒY�f�����Q���Ȃ��A�V��CoA�ƂȂ锽���B
�V�D�P�g���̐����ɂ��Ă̑�ӂƈӋ`
�@�@���b�_��s���r���_�̎_���ɗR������A�Z�`��CoA�̈ꕔ��V���̃A�Z�g�|�_��D-��-�q�h���L�V���_�ɓ]������y�f�n�������Ă���B�V���̃A�Z�g�|�_�̓A�Z�g�A�Z�`��CoA���琶���A���̃P�g���̂��A�Z�g�|�_��O��̂���B
�@�@�A�Z�g�A�Z�`��CoA�̈ꕔ�̓~�g�R���h���A�̃}�g���N�X�Œ������b�_����A�Z�`��CoA�P�ʂ������_���I�ɏ������ꂽ���Ƃ̂S�̒Y�f���q���琶����B�������A�Z�g�A�Z�`��CoA�̑啔���́A���b�_���Ő������A�Z�`��CoA�Q���q���A�Z�`��CoA�A�Z�`���g�����X�t�@�[�[�ɂ��k�����Đ�����B
�@�@�@�@�@�A�Z�`��CoA�{�A�Z�`��CoA�̃A�Z�g�A�Z�`��CoA�{CoA
�@���̔����Ő������A�Z�`��CoA�͎����ŒE�A�V���������CoA�������A�V���̃A�Z�g�|�_����B���̉ߒ��̓~�g�R���h���A�̃}�g���N�X�ɂ�����ʂȌo�H�ŋN����B���̔����͌��ǁA�@�@�@�A�Z�`��CoA�{H2O���A�Z�g�|�_�{CoA�@�@�@�ƂȂ�B
�@�@���̂悤�ɂ��Đ������V���A�Z�g�|�_�̓~�g�R���h���A������NAD�nD-��-�q�h���L�V���_�f�q�h���Q�i�[�[�ɂ��A�y�f�I�ɊҌ�����D-��-�q�h���L�V���_�ɂȂ�B
�@�@�@�@�@�A�Z�g�|�_�{NADH�{H�{��D-��-�q�h���L�V���_�{NAD�{
�@���̍y�f�͗V����D���ِ̈��̂ɓ��ٓI�ł���B���̍y�f��D-��-�q�h���L�V���_CoA���Ҍ����Ȃ��B�����̔����Ő������V���̃A�Z�g�|�_�ƃ�-�q�h���L�V���_�̍������͊̍זE����g�U���Č��t�ɓ���A�����g�D�ɉ^���B
�@�@�����g�D��D-��-�q�h���L�V���_�͎_������ăA�Z�g�|�_���A�����ŃT�N�V�j��CoA�i�R�n�N�_CoA�j����CoA��������āA�A�Z�g�A�Z�`��CoA�Ɋ����������B���̃T�N�V�j��CoA�̓�-�P�g�O���^���_�̎_���i�g���J���{���_�T�C�N���j�ɐ�����B�����̔����Ŗ����g�D���ɐ������A�Z�g�A�Z�`��CoA�͎����ŃI���V�X�J�ăA�Z�`��CoA2���q���A�g���J���{���_�T�C�N���ɓ���B
�@�@�@�@�@�@�T�N�V�j��CoA�{Pi�{�{GDP���R�n�N�_�{GTP�{CoA-SH
�@�P�g���̐����̈Ӌ`
�@�@�@���]�q�h���L�V���_�͂��̂悤�ɂ��đS�Ă̑g�D�̃g���J���{���_�T�C�N���ŏ����邪�A����������ł̔]�ł̏���͂��Ƃɒ������B���퉻�ł͔]�̓O���R�[�X�݂̂�����邪�A�����Ԃ̐�H���ɂ̓O���R�[�X�̋�����������̂ŁA�]�͊̑��Ő�������-�q�h���L�V���_����ȔR�����Ƃ��ė��p����B����̓A�Z�`��CoA�ɓ]�����A�����Ńg���J���{���_�T�C�N���ɓ���B
�q�^���p�N���ƍy�f�̉��w�r
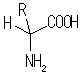
�P�D�A�~�m�_�̈�ʂɂ����Ă��鉻�w�I�����Ɖ��w�\���B�܂���ʓI�ȕ��ށB
�@�@�@���ꕪ�q���ɃJ���{�L�V����ƃA�~�m������L���鉻�����B�J���{�L�V����������Ă���Y�f����ɂ��ăA�~�m��������Ă���Y�f���q�̈ʒu�ɂ��A���A���A���c�A�~�m�_�Ƌ�ʂ���B���A�~�m�_�̓^���p�N�����\������ł��d�v�ȃA�~�m�_�ŁA
�@�@�@�@�R�|CH(NH2)COOH��@�@�̍\�����ŕ\�����B�\���̍ł��ȒP��R��H�ł���O���V���ȊO�̊e�A�~�m�_�́A���Ȃ��Ƃ�1�̕s�ĒY�f���q�������A���w�I�Ɋ����ł���B�O���Z���A���f�q�h��D,L�^�\���ɏ����āAD,L-�A�~�m�_����ʂ���B���̓��̃A�~�m�_�͂قƂ�ǂ�L�^�ł���B�A�~�m�_�͏��Ȃ��Ƃ�2��̃C�I�����\�ȉ𗣊���������d�����ł���B�ʏ퐶���IpH�͈̔͂ł̓J���{�L�V����̓v���g������o�����`�ő��݂��A�A�~�m��̓v���g������e�����`�ő��݂���B
|
���� |
�A�~�m�_ |
�R�����L�� |
�P�����L�� |
|
���b�� �A�~�m�_ |
�O���V�� |
�f���� |
�@�@�f |
|
�A���j�� |
�`���� |
�@�@�` |
|
|
���} �A�~�m�_ |
�o���� |
�u���� |
�@�@�u |
|
���C�V�� |
�@�k���� |
�@�@�k |
|
|
�C�\���C�V�� |
�h���� |
�@�@�h |
|
|
�q�h���L�V �A�~�m�_ |
�Z���� |
�@�r���� |
�@�@�r |
|
�g���I�j�� |
�@�s���� |
�@�@�s |
|
|
�_�� �A�~�m�_ |
�A�X�p���M���_ |
�@�`���� |
�@�@�c |
|
�O���^�~���_ |
�f���� |
�@�@�d |
|
|
��� �A�~�m�_ |
���V�� |
�@�k���� |
�@�@�j |
|
�A���M�j�� |
�@�`���� |
�@�@�q |
|
|
�A�~�h�^ �A�~�m�_ |
�A�X�p���M�� |
�`�����@ |
�@�@�m |
|
�O���^�~�� |
�@�f���� |
�@�@�p |
|
|
�ܗ� �A�~�m�_ |
�V�X�e�C�� |
�b���� |
�b |
|
���`�I�j�� |
�l���� |
�l |
|
|
�F���� �A�~�m�_ |
�t�F�j���A���j�� |
�@�o���� |
�@�@�e |
|
�`���V�� |
�@�s���� |
�@�@�x |
|
|
���f�� �A�~�m�_ |
�g���v�g�t�@�� |
�@�s���� |
�@�@�v |
|
�q�X�`�W�� |
�@�g���� |
�@�@�g |
|
|
�C�~�m�_ |
�v������ |
�@�o���� |
�@�@�o |
�Q�D�A�~�m�_�E�^���p�N���̉דd����ѓd�C�j��
�@�@�A�~�m�_��^���p�N���ȂǗl�X�ȗ��q�͐����ɂ����ẮA���d�_�ƌ��������̂��g�ȊO�ł́A�v���X���邢�̓}�C�i�X�̏�ԂɂȂ��Ă���B���̂��Ƃ��דd�ƌ����B���̂悤�ȃv���X���邢�̓}�C�i�X�ɉדd���Ă���A�~�m�_��^���p�N���ɓd���������Ɖדd�Ɣ��Ε����̓d�ɂɌ������Ĉړ�����B���̌��ۂ�d�C�j���ƌ����B���̓d�ׂ͗��q�ƍs�����Ƃ��ɂ���̈���ł̃C�I���̕��z�Ɉˑ�����̂ŁA�d�C�j�����鑬���͐G�}�̉��Z�x�E�C�I���g���ɂ���đ傫�����E�����B
�R�D�^���p�N���̃A�~�m�g���̈Ӌ`�Ƃ��̕��͖@
�@�A�~�m�_�g���̕��͖@
�@�@�@�A�~�m�_�g�������߂�ɂ͂܂��^���p�N�����A�~�m�_�܂Ŋ��S�ɕ�������B����ɂ͋��_�őS�Ẵy�v�`�h������������������B�����ăV���J�r�[�Y�̃J�����ɂ��̗V���A�~�m�_�̍�������ʂ��B����͉t�̃N���}�g�O���t�B�[�Ƃ��Ēm���Ă�����@�ł���B���ꂼ��̃A�~�m�_�͓���̑����ŃJ�������痬��o��B�J��������̗n�o���ׂ���Ƃ̃^���p�N���Ɋ܂܂��A�~�m�_�̎�ނƂ��̊ܗʂ��v�Z���邱�Ƃ��ł���B
�@�A�~�m�_�g���̈Ӌ`
�@�@�@���q�̌��f���͂Ɠ����悤�Ƀ^���p�N���̃A�~�m�_�g�����炨�̂��̂̃A�~�m�_���ǂꂭ�炢�܂܂�Ă��邩�Ƃ������͓����邪�A�ǂ�ȏ����ŃA�~�m�_������ł��邩�͕�����Ȃ��B����ɑ��ă^���p�N���̃A�~�m�_�z��͎w��̂悤�Ȃ��̂ŁA�^���p�N���̌��܂�A�~�m�_�̕��ѕ����͂����肷��B�A�~�m�_�̕��ѕ���������A�l�H�I�Ƀ^���p�N�����ł��邱�ƂɂȂ�B�A�~�m�_�g���́A�A�~�m�_�z��ȒP�Ɍv�Z�ł���B
4�D�^���p�N���̍\���Ƃ����ێ����Ă���@�\�@�@
�@�@�S�̊K�w�\�����^���p�N���̌`�����߂Ă���B
�^���p�N���̈ꎟ�\��(primary structure)�Ƃ́A�|���y�v�`�h���\������A�~�m�_�c��̒�����̕��ѕ��B�܂�z��(sequence)�������B�^���p�N���̃A�~�m�_�z��ł́A�^���p�N�����\�����Ă���A�~�m�_�c��̐�����ѕ��A�܂�ꎟ�\�������߂�B
�@�@�\��(secondary structure)�̓|���y�v�`�h���̈ꕔ���̋Ǐ��I�ȑg�D���̂��Ƃ������B�P�{�̃|���y�v�`�h���͑S�Ẵ^�C�v�̓\�����܂݂���B���艻�Ɋ�^���鑊�ݍ�p�������Ȃ��ƁA�|���y�v�`�h�̓����_���R�C��(random coil)�\�����Ƃ�B���������艻�Ɋ�^���鐅�f�������c��Ԃɂł���ƁA�|���y�v�`�h�̍��i�\���́A���w���b�N�X(�� helix, �点���|���y�v�`�h)������(�� stand, �����L���ꂽ�|���y�v�`�h)�Ƃ����B��̊w�I�z�u�̂ǂ��炩����̌`�ɐ܂肽���܂��B �����͉��ɉ�������V�[�g(�� sheet)���`������B�Ō�Ƀ^�[��(turn)�͂S�c��łł����t���^�̂��������ŁA�t�̘r�̍\���ŁA�t�̘r�̊Ԃ̐��f�����ň��艻����Ă���B�^�[���̓^���p�N���̕\�ʂɂ����āA�|���y�v�`�h���̌�����]��������B
�@�@���̊K�w�͎O���\�� (tertiary structure) �ŁA�A�~�m�_�c��̎O�����I�Ȕz�u�������B���f�����ň��艻����Ă���\���ɑ��āA�O���\���͔�ɐ������̑a�����ݍ�p�Ō`�������B���փ��b�N�X������A���邢�̓����_���R�C���͑a�����ݍ�p�ŏW�����āA�����l�܂����^���p�N���������\������B�^���p�N���̑傫����`�́A�A�~�m�_�z���łȂ��\���̐��A�傫���A�z�u�ɂ����B�P�{�̃y�v�`�h������ł��Ă���^���p�N���A�܂�P�ʑ̃^���p�N�� (monomeric protein) �ł͎O���\�����ł������̊K�w�\���ł���B
�@�@���ʑ̃^���p�N�� (multimeric protein) �́A�L�����ʼn��������̃T�u���j�b�g�����B�l���\�� (quaternary structure) �́A���ʑ̃^���p�N�����ł̃T�u���j�b�g�̐��i�ʔ�j�₻�̑��Έʒu��\���B�Ԍ����ÏW�f�͓���̃T�u���j�b�g�O����Ȃ�O�ʑ̂ł��邪�A���̑��ʑ̃^���p�N���ł́A���ꂠ�邢�͈�����T�u���j�b�g�̂��낢��ȑg�ݍ��킹���\�ł���B�����A�T�u���j�b�g�̔z�u�͋K���I�A�Ώ̓I�ł���B�Ⴆ�ΐԌ����ÏW�f�O�ʑ͎̂O���]�Ώ̎��������Ă���B
�@�@�܂��ێ�����@�\�ɁA���̔z�u�i�R���t�B�M���[�V�����j�Ɨ��̔z���Ƃ�����B���̔z�u�Ƃ́A���ِ̈��̂̒u����̋�Ԕz�u���w���B���̂悤�ȍ\���̂̑��ݓ]���ɂ͕K���P�{�ȏ�̋��L�������Ȃ���Ȃ�Ȃ��B���̔z���Ƃ́A���q���̒P�����̂܂��̉�]�̂��߂ɁA������炸�Ɏ��R�ɂ������̈قȂ����ʒu���Ƃ肤��u����̋�Ԃ͈ʒu���w���B
�T�D�y�f�̖{�͉̂����B�܂��y�f�̓��ِ��A�j�Q�܁A�Ƒj�Q�@�\�A�y�f�����ɋy�ڂ����x�ApH�̉e���B
�@�@�@�y�f�Ƃ́A����������G�}���邽�߂ɓ��ꉻ�����^���p�N���ł���B�y�f�͐l�H�I�ȐG�}�܂����͂邩�ɍ��������ׂ����ِ��ƐG�}�\�����B
�@�y�f�̓��ِ�
�@�@�@�y�f�͊��I��D�݂���B���̐���������ِ��Ƃ����B���̐����ɂ͒��x�̍�������A���ِ��������ȍy�f�͂����P�̕���������ɂ��Ȃ��B�O���R�[�X�I�L�V�_�|�[�̓O���R�[�X�ɂ���p���Ȃ����A�փL�\�L�i�[�[�͂���قnj��i�ł͂Ȃ��A�O���R�[�X�A�}���m�[�X�Ȃǂ̊���̒P���ɍ�p����B�փL�\�X�I�L�V�_�|�[�͂���ɓ��ِ�����邭�A�P�����肩�}���g�[�X�Ȃǂ̓ɂ���p����B�܂��y�f�͌��w�ِ��̂������ʂ��邱�Ƃ��ł���B���̂悤�ɍy�f�����w�ِ��̂����ʂł��闝�R�́A�y�f������q��̏��Ȃ��Ƃ��R���Ƒ��ݍ�p�ł���悤�ȍ\���������Ă��邽�߂ł���B�������Q���Ƃ������ݍ�p�ł��Ȃ�������A���w�ِ��̂���ʂ��邱�Ƃ͂ł��Ȃ��B
�j�Q�܂Ƒj�Q�@�\�@
�@�@�y�f�Ɍ������āA�y�f�̓�����}���镨��������A�j�Q�܁iinhibitor�j�Ƃ�сA���������痣��Ȃ��s�t�j�Q�܂ƌ��������ꂽ�肷��t�j�Q�܂�����B�t�j�Q�܂ɂ͂���ɋ����j�Q�܂Ɣ��j�Q�܂Ƃ�����B�����j�Q�܂͊�������ʂɌ������Ċ���y�f�Ɍ�������̂��ז�����̂�Michaelis�萔(Km)���傫���Ȃ�B����ߏ�ɂ���Ƒ��ΓI�ɉe�����������Ȃ�̂ŁA�ő呬�x�͕ς��Ȃ��B���j�Q�܂͊�������ʂɌ������čy�f�̌�����ቺ������̂ŁA�ő呬�x���ቺ���Ă��܂��B
�y�f�ɂ����炷���x�EpH�̉e��
�@�@���w�����͉��x�������Ȃ�Ȃ�قǑ����i�ށB�������y�f�ŐG�}����锽���̏ꍇ�͉��x���オ�肷����Ƃ������Ĕ������x���ቺ����̂ŁA�ő劈�����������x������A�œK���x�Ƃ����B������z����ƍy�f�����͋}���ɒቺ���āA�₪�đS�������������Ȃ�B����͍y�f���^���p�N���ł��邽�߂ɁA�����ł͗��̍\�������ĕϐ����A�G�}��p�������Ȃ��Ă��܂�����ł���B�唼�̍y�f�̍œK���x��50���t�߂ł���B�܂����x���lpH�ł��y�f�̓����͑傫���e�����A�y�f�̊������ł�����pH���œKpH�Ƃ����B�����̍y�f�̍œKpH�͑̓����ɓK������7�t�߂ŁA10�ȏ��4�ȉ��ł͊��������ɒႭ�Ȃ�B��������O������A�݂œ����v���e�A�[�[�ł���y�v�V���́A���_���܂�Ŏ_���ɂȂ����݉t�̒��œ������Ƃ��ł���悤�ɁA�œKpH��2�t�߂ł���B
�U�D�~�J�G���X�iMichaelis�j�萔�̗��_�Ƒ���@
�@�~�J�G���X�萔�iKm�j�Ƃ͔������x�����ő呬�x�u��1/2�ɂȂ�悤�Ȋ�Z�x�i�k�r�l�j�ł���B�܂������ꂾ������Ƃ����Ƃ��ɁA�y�f�͎��Ȃ̔\�͂̔������o���ē����B�܂�1����1��x�ނƂ�����Ԃɂ���BKm���������Ƃ������Ƃ͊�����Ȃ���������悭�����Ƃ������Ƃł���AKm���傫���Ƃ������Ƃ͊�������Ȃ���Έꐶ�����Ȃ��Ɠ����Ȃ��Ƃ������ƂɂȂ�B�y�f�Ɗ�̑g�ݍ��킹�ɂ��Km�l�͕ς��AKm�l���������قǂ��̍y�f�Ɗ�Ƃ͑������悢�B�܂�y�f�ɓK������Ƃ������ƂɂȂ�B
�@�~�J�G���X�萔�͎����I�Ɍ��߂��A����I�Ɍ��߂���萔�ł���B�܂蔽�����x�����ő�l�̂Ƃ��̊�Z�x�ł���B����ė��z�����������ł�Km��
�@�@�@�@�@�@Km��k�|1�{��+2�^��+1�@�@�@�@�@�@�ƕ\�����B
����������̍y�f�����ł͂��|1�͂�+2�Ɣ�ׂĔ��ɑ傫���A���̏ꍇ��+2����������قǏ������Ȃ�̂ŁA��̎��́A
�@�@�@�@�@�@Km�����|1�^k+1�@�@�@�@�Ɋȗ��������B
�V�D�������G�l���M�[�A���R�G�l���M�[�A���G�l���M�[����
�@�������G�l���M�[(activation energy)
�@�@�@�������G�l���M�[�Ƃ́A���w�����ɂ����Ĕ�������(���q)����(���邢�͕��q�Ԃ�)����̌������A�V������ԂɈڂ�(�V���Ȍ�������)���߂ɂ́A���Y���q������ʂ̃G�l���M�[���������s����ȑJ�ڏ��(���������)�ɂȂ�K�v������B���̏�ԂƊ���ԂƂ̃G�l���M�[�����������G�l���M�[[�܂��͊��������R�G�l���M�[(activation free energy)]�Ƃ����B��ʂɔ������x�����x�̏㏸�ƂƂ��ɑ����Ȃ�̂́A�M�̌`�ł��̃G�l���M�[�����镪�q�̐�����������ł���B�G�}�́A�������G�l���M�[��ቺ�����邱�Ƃɂ�蔽���𑣐i����B
�@���R�G�l���M�[(free energy)
�@�@�@���R�G�l���M�[�Ƃ́A�M�͊w�̏�Ԋ��̈�B�ʏ�̎����������ɂ�����M�͊w�I���t�̊��\���B��Ԃ��ω��\�Ȍn�͕��t�ɋ߂Â��ɂ��������ăG���g���s�[�͋ɑ�ɁA�����G�l���M�[�͋ɏ��̕����ւƕω����Ă����A�n�����t��ԂɂȂ������Ɏ��R�G�l���M�[���ɏ��l�ɂȂ�B���Ȃ͂��n�̎����I�ω��͎��R�G�l���M�[�̋ɏ��̕����ւƕω�����B���w�����ɂ����Ă����l�ŁA���w���t��Ԃł͌n�̎��R�G�l���M�[���ɏ��ƂȂ�B�舳�ߒ��ɓK�����M�u�Y�̎��R�G�l���M�[�ƁA��e�ߒ��ɓK�����w�����z���c�̎��R�G�l���M�[������B
���G�l���M�[����(high-energy bond)
�@�@�@���̕��q�̓���̌����̉��������ɂ�����W�����R�G�l���M�[�ω����傫���ꍇ�ɂ��̌��������G�l���M�[�����ƌĂԁBF�DLipmann �ɂ��ATP�̃s�������_������z�X�z�N���A�`���̃����_�����ɑ��Ďg��ꂽ���A���ł̓����_�����ȊO�ɂ��g������Ă���B���w�\���Ƃ��ẮA�s�������_��z�X�z�O�A�j�W���_�ȊO�ɃA�V�������_��z�X�z���_�Ȃǂ̍����_�������A�G�m�[�������_�G�X�e���A�`�I�G�X�e���A�X���z�j�E�������̌������܂ށB
�W�D��y�f�̗�������āA�r�^�~���Ƃ̍\����̊֘A�Ƃ��̖����̐���
�@�@�@��y�f�̗�Ƃ��āA�`�A�~�����_(TPP)���ɂ����ăr�^�~���Ƃ̊W�Ƃ��̖�����������BTPP�̓r�^�~��B1(�`�A�~��)�s�������_�G�X�e���ŁA�`�A�~���̃`�A�]�[�����E�Y�f�_�y�f�̕�y�f��p���c�ށB�r�^�~��B1�̌��R�́A���̑�ӈُ�������N�����A�����s���r���_�Z�x���㏸���ċr�C�ƂȂ�B
�@�@�@���̕�y�f�̓s���r���_���A�Z�`��CoA�ɒE�Y�f���锽���ŗ��p�����s���r���_�f�q�h���Q�i�[�[�����̂�3�̍y�f�̍y�f�T�̕���q�ł���B���̍y�f�T���s���r���_��E�Y�_����B
9�D�y�f�̕���
�@�@�ȒP�ȑ��זE�����ł��A�̓��ł͂����炭�����ȏ�̍y�f�������Ă���B�����̍y�f�ސ������邽�߂ɁA�G�}���锽������Ƃ��āA�傫��6�̃O���[�v�ɕ�����B�����Ă��ꂼ�������ɒ����ށA�����ނ��Ă䂫�ŏI�I�ɑS�Ă̂����̍y�f��4�̐����R�[�h�ŋ�ʂł���悤�ɂ��Ă���B
�@�@�y�f�̕��ޕ\
|
�y�f�̕��ޖ� |
�y�f�̓��� |
�y�f�̎�ނ̗� |
|
�_���Ҍ��y�f |
���f�A�_�f�A�d�q�Ȃǂ̈ړ� |
�E���f�y�f �_���y�f |
|
�]�ڍy�f |
��(���q�c)�̈ړ� |
�A�~�m��]�ڍy�f |
|
���������y�f |
�������� |
�@�j�_�����y�f |
|
�E���y�f |
���������d�������c������Ԃŕ��� |
�E�Y�_�y�f |
|
�ِ����y�f |
�ِ������� |
|
|
�����y�f |
ATP�̕����ɂ��G�l���M�[�𗘗p����2���q������ |
�f���v�������y�f |
�q�j�_�̉��w�r
1�D �j�_�̃v��������ƃs���~�W������A�k�N���I�V�h�ƃk�N���I�`�h�̍\���Ǝ�ނ̐���
�v��������ƃs���~�W������
�v�����A�s���~�W���͂Ƃ��ɉ���̊ܒ��f���f���������ŁA�v���������C5H4N4 �̍\���������A�s���~�W������� C4H4N2�̍\�������B�ʏ�\�����ł͊�C���q�Ƃ���Ɍ�������H���q�́A�ȗ�����B�A�f�j���iA�j��6-�A�~�m�v�����A�O�A�j���iG�j��2-�A�~�m-6-�I�L�\�v�����̍\�������v�����U���̂ł���B����V�g�V���iC�j��4-�A�~�m-2-�I�L�\�s���~�W���A�`�~���iT�j��5-���`��-2,4-�W�I�L�\�s���~�W���A�E���V����2,4-�W�I�L�\�s���~�W���̍\�������s���~�W���U���̂ł���B
�@�@�@�v�����@�@�@�@�@�@�@�@�@�@�@�s���~�W��
�@�k�N���I�V�h
�@�@�k�N���I�V�h�Ƃ́A�L�@������Ɠ������������������̂ł���B���{�k�N���I�V���́A�v�����U���̂�9�ʂ܂��̓s���~�W���U���̂�1�ʂ�N���q�����{�[�X��1�ʌ��q�ƃ�-�O���R�V�h�������`�����邱�Ƃɂ�茋�������������ł���B�v�����̃��{�k�N���I�V�h�ɂ̓A�f�j���g���{�[�X�����������A�f�m�V���iAdo�CA�j�ƁA�O�A�j���g���{�[�X�����������O�A�m�V���iGuo�CG�j������A�I�V���ŏI��閼�̂����B����ɑ��s���~�W���k�N���I�V�h�ɂ́A�V�g�V���g���{�[�X�����������V�`�W���iCyt�CC�j�ƁA�E���V���ƃ��{�[�X�����������E���W���iUrd�CU�j������A�C�W���ŏI��閼�̂����B�f�I�L�V���{�[�X���܂ރk�N���I�V�h�ɂ́A�f�I�L�V�Ƃ����ړ����t���A�Ⴆ�f�I�L�V�A�f�m�V���idAdo�CdA�j�̂悤�ɌĂ��B�������`�~���ƃf�I�L�V���{�[�X�̌����Ő�����f�I�L�V�k�N���I�V�h�̂��Ƃ́A��O�I�Ƀ`�~�W���ƌĂ�ł悢�B�k�N���I�V�h����C���q�̈ʒu�ԍ��͓��̂��̂ɂ��f�����L�@������̌��q�Ƌ�ʂ���B�V�R�̊j�_���ɂ́A�ʏ��A,G,C,T,U�̂ق��ɁA�\���̈�����C���k�N���I�V�h�����ʂɊ܂܂�Ă���B�Ⴆ�A�O���R�V�h������G�|N�ł͂Ȃ�C�|C�����ɂȂ������̂�A�������≖����Ƀ��`�����������̂Ȃǂ�����B
�k�N���I�`�h
�@�@�k�N���I�`�h�Ƃ́A�k�N���I�V�h�̓�������OH��ƃ����_��G�X�e�������������̂ł���B���������āA�����_�1�����������{�k�N���I�`�h�ł́A2�f�A3�f�A5�f��3��ِ̈��̂��A�f�I�L�V���{�k�N���I�`�h�ł�3�f��5�f��2��ِ̈��̂����݂���B�k�N���I�`�h�𗪍��ŏ����Ƃ��ɂ́A�����_�5�f��Ɍ����������́i5�f-�k�N���I�`�h�j�̓k�N���I�V�h�����̍����ɁA3�f�ʂɌ����������́i3�f-�k�N���I�`�h�j�͉E����p�����Ď������ƂɌ��߂��Ă���B�Ⴆ�A�A�f�j����5�f-�k�N���I�`�h�ɂ́AAMP�̂ق���pA�Ƃ���������������BATP�̓A�f�m�V����5�f�ʂɃ����_��3�����������̂Ȃ̂�pppA�Ɨ����Ă��悢�B
2�D ������
�Z���g�����h�O�}(central dogma)�c��`���̈�ʌ����Ƃ��ď�����ꂽ�l�����B���Ȃ킿DNA�ɂ���ĒS��ꂽ��`���́ADNA���g�̕����ɂ���āA�q���ւƈێ��A�`�B����Ă䂭�B���̈���ň�`����DNA����RNA�A������RNA����^���p�N���ւƓ`�B�A�������Ă������A���̗���͈���ʍs�ł���A��������^���p�N���Ƃ��Ĕ��������ƁA���̏�j�_�ɖ߂���邱�Ƃ��Ȃ���ARNA����DNA�ɖ߂���邱�Ƃ��Ȃ��B�܂��`���̗���͈�����݂̂ŁA�t�����邱�Ƃ͂Ȃ��B�������t�]�ʍy�f�����݂���ƁARNA����DNA�Ƃ������ꂪ���݂���B�@
DNA�|�������[�[�iDNA polymerase�j�cEC2.7.7.7.DNA�����ɂ�����DNA���̐L�����s���y�f�BDNA�|�������[�[��5�f��3�f�̕����ɂ̂�DNA����L������Ƃ�����ʓI���������B�咰�ۂł�DNA�|�������[�[�T�E�U�E�V��3��(�^�j�����ł�5��)������B�����̍y�f�͂�������f�I�L�V�k�N���I�V�h�O�����_(dNTP)����Ƃ��A�������Ă���DNA����3�f���[�́|OH��Ƀk�N���I�`�h������������B�ǂ̃k�N���I�`�h�����������邩�͒��^DNA�����߂�BDNA���̉�����5�f��3�f�����ɋN���A�܂����łɍ������ꂽ���̖��[�Ƀk�N���I�`�h��t�����邪�A���ꎩ�g��DNA���̐L�����J�n�ł����A�K���v���C�}�[��K�v�Ƃ���B���̐������v���C�}�[�v�����Ƃ����B
RNA�|�������[�[�c���j������RNA�|�������[�[��1��ނŁA4�̃T�u���j�b�g��2�����f����Ȃ�R�A�y�f�ƁADNA�̓]�ʊJ�n�_�Ɍ�������Ј��q����Ȃ�BRNA�|�������[�[��DNA�Ɍ������镔�ʂ̓v�����[�^�̈�ł���B�v�����[�^��2��������A�]�ʊJ�n�_�̖�10����㗬�́|10�z��(TATAAT�GPribnow�{�N�b�X)�ƁA��35����㗬�́|35�z��(TTGACA)�ł���B�v�����[�^�z�����ς������A�v�����[�^�Ԃ̋������ω�����Ɠ]�ʌ������ς��B�����v�����[�^�ł�2s��1��̊����œ]�ʂ����̂ɑ��A�ア���̂ł�10min��1����x�ƂȂ�BRNA�|�������[�[��DNA�ɉ����Ĉړ��A�v�����[�^��F�����A���̏��DNA��{�����قǂ��B���̐�������̃v����(A�܂���G)���獇�����J�n����B���������RNA����5�f���[�͎O�����_�������܂܂�pppA�܂���pppG�ł���B�咰�ۂ������Ŕ|�{����ƈقȂ�Ј��q�������A�M�V���b�N�v�����[�^����̓]�ʂŔM�V���b�N�^���p�N(hsp)��������B
�@���������J�n����ƃЈ��q��RNA�|�������[�[���痣��ARNA�����̓R�A�y�f�ɂ��i�s����BRNA���������ł͐i�s������DNA�����قǂ��Ȃ���i�s���邪�A����DNA���͍Ăъ��߂����{���ƂȂ�B�Ǐ��I�ɓ�{�����قǂ��������ɓ]�ʃo���u�Ƃ���RNA�|�������[�[��RNA�|DNA�����������������\�����`������B�قǂ����DNA�̈�́A��17bp�A���������̑����͖�50����/s�ł���BRNA�����̃G���[�p�x��104�`105��1����x�ł���BRNA�����̏I����RNA�|DNA���������𗣂��ARNA�|�������[�[�KDNA���痣��邱�Ƃɂ���čs����B����͂���߂Đ����ɒ��߂���邪�A�]�ʏI���ɂ͂����Ƃ��P����GC�ɕx�̈�i�w�A�s���\���j�ɑ�������U�c��ɂ�钒�^DNA�̔z��ŏI������ꍇ�ƁAATP�����y�f��1�ł���I�����q��(���[)���q(�^���p�N)�ɂ��I������ꍇ�Ƃ�����B
�@�^�j�����ł�3���RNA�|�������[�[�����݂���BRNA�|�������[�[�T�͊j���̂ɑ��݂�18s�A5.8S�A28SrRNA�̍������s���BRNA�|�������[�[�U�ƇV�͊j�����ɑ��݂���BRNA�|�������[�[�U��hnRNA�Ƃ�����mRNA�O��̂�RNA�|�������[�[�V�́AsnRNA(�j���蕪�qRNA)�AtRNA�A�����5SrRNA�̍�����G�}����B�]�ʂ��J�n���邽�߂̃v�����[�^�z��͌��j�זE�ƈقȂ�A����Ƀv�����[�^�ߖT�ɂ͓]�ʂ𑣐i����G���n���T�̈悪���݂���B
RNA�̃v���Z�b�V���O�ctRNA��rRNA�̃v���Z�b�V���O�F�咰��RNA�̃v���Z�b�V���O�ł́A�������ꂽ30SRNA����16S�C23S�C5SrRNA����ѐ���ނ�tRNA��RN�A�[�[�V�̓����ɂ���Đ�o�����B16SrRNA��30S���{�\�[���T�u���j�b�g������A�����2�̃T�u���j�b�g��������70S���{�\�[�����ł���B�܂�tRNA��30SRNA�ȊO�ɂ�tRNA�O��̂��ؒf�y�f�Ő�o�����B�ؒf�y�f��1�͐G�}��p������RNA���܂�RN�A�[�[Pp�ł���B�ؒf��A����ɓ��蕔�ʂ̃k�N���I�V�h�Ⴆ��U�̓��{�`�~�W����V���[�h�E���W���ȂǂɏC�������B�^�j�זE�̏ꍇ�A�������ꂽtRNA�����rRNA�ɂ́A�C���g�������܂܂�A�X�v���C�V���O�A��o���A�C���ߒ����o�Đ��n�^�ƂȂ�B
��RNA�v���Z�b�V���O�FmRNA�v���Z�b�V���O�ɂ�mRNA�O��̂̃X�v���C�V���O(�C���g�����̏����Ƃ��̑O��̃G�L�\���̍Č�������)�AmRNA��5�f���[�ւ�7-���`���O�A�m�V���L���b�v�\���̕t���A3�f���[�ւ̃|��(A)�z��̕t���A���`�����Ȃǂ̉���C���������܂܂��B���`�̂�RNA�v���Z�V���O�Ƃ��āAmRNA�O��̂̃X�v���C�V���O�����݂̂������ꍇ������B
�G�L�\���ƃC���g����
�G�L�\���F���f���ꂽ��`�q�ŁA�ŏI�I�Ȑ��nRNA�ƂȂ镔����DNA�z��(RNA�ɂ��p������)�������B�ꎟ�]�ʎY������C���g������������菜����A�G�L�\���������Ȃ����킳�邱�Ƃɂ��A�^���p�N�������̒��^�ƂȂ�@�\�I�Ȑ��nmRNA����������B
�@�C���g�����F�^�j�����̈�`�qDNA���ɑ��݂����ݔz��ŁA�ꎟ�]�ʎY���ɂ͊܂܂�邪�ŏI�̋@�\�I�Ȑ��nRNA�ɂ͊܂܂ꂸ�A�X�v���C�V���O�ɂ���菜������`�q�̈������(RNA�ɂ��p������)�B�A����e�g���q���i�̃C���g�������ɂ͂���RNA���̂Ŏ��ȃX�v���C�V���O�@�\�������̂�����A�O�A�m�V���v��������O���[�v�T�^�ƃO���[�v�U�^�C���g�����ɕ�������B�T�^�C���g�����̏����ɂ�Mg2+�ƃO�A�m�V��(GMP,GDP,GTP�ł���)�v����������B�U�^�C���g�����̏����ɂ�Mg2+�ƃX�y���~�W�����K�v�ł���A�O�A�m�V���v�����͂Ȃ��B�U�^�C���g�����̏����ɂ́A�C���g�������̃A�f�j���c���2�f-5�f�����ɂ�铊�����\�����`������A���������̃X�v���C�V���O�@�\�ɗގ����Ă���B
�j�_�����y�f(�k�N���A�[�[)����j�_��|���k�N���I�`�h�̃k�N���I�`�h�Ԃ�A������z�X�z�W�G�`���G�X�e���������J��y�f�A�k�N���I�z�X�z�W�G�X�e���[�[�̑��̂Ƃ��ėp������B��̓������ɑ�����ِ��ł킯���DNA����������f�I�L�V���{�k�N���A�[�[(DN�A�[�[)�ARNA�ɍ�p���郊�{�k�N���A�[�[(RN�A�[�[)�A�����������ʂ���DNA�ɂ�RNA�ɂ���p����y�f��3��ނɕ��ނ����B���`�ɂ͒P�ɂ��̑�O�̍y�f���k�N���A�[�[�Ƃ������Ƃ�����B����l���ŕ��ނ���ƃ|���k�N���I�`�h��������3�f�A5�f-�z�X�z�W�G�`��������ؒf����G���h�k�N���A�[�[�ƍ���5�f���[�܂���3�f���[����k�N���I�`�h������1���ؒf���Ă����G�L�\�k�N���A�[�[�ɕ�������B�G���h�k�N���A�[�[�A�G�L�\�k�N���A�[�[�Ƃ��ɕ����Y�������5�f���[���烊���_������k�N���I�`�h������5�f-p�����y�f�ƁA3�f���[�Ƀ����_������k�N���I�`�h������3�f-p�����y�f�ɕ��ނ���B�z�X�z�W�G�X�e���������������������Ƃ��ɂ́A�y�f�̓��ِ��ɂ����5�f�ʂɃ����_��c��3�f�ʂɃq�h���L�V�������ꍇ�ƁA�t��3�f�ʂɃ����_��c��5�f�ʂɃq�h���L�V�������ꍇ������B�G�L�\�k�N���A�[�[�ɂ͂قƂ�lj�����ِ����Ȃ����A�G���h�k�N���[�[�ɂ́A����ɔ���ٓI�ȃk�N���A�[�[�ƁA���鉖��܂��͉���z���F�����Ċj�_���̓��ٓI�����݂̂�ؒf����k�N���A�[�[��2��ނ�����B�Ⴆ��RN�A�[�[T1�̓O�A�j���_��3�f���݂̂Őؒf������̂ŁA�������I���S�k�N���I�`�h��3�f���[��Gp�ł���BRNA���ꎩ�g��RN�A�[�[�����������̂������o���ꂽ�B
|
�y�f�� |
� |
������ |
|
|
�G �� �h �k �N �� �A �T �[ |
�X��DN�A�[�[�T |
��{������ѓ�{����DNA |
5�f-p�3�f-OH�����I���S�k�N���I�`�h |
|
�X��DN�A�[�[�U |
��{������ѓ�{����DNA |
3�f-p�5�f-OH�����I���S�k�N���I�`�h |
|
|
�k�N���A�[�[P1 |
��{������ѓ�{����DNA,RNA |
5�f-���m�k�N���I�`�h(3�f-�ʂ̃����_����������) |
|
|
�k�N���A�[�[S1 |
��{����DNA |
5�f-p�3�f-OH������{��DNA�D��{�����������5�f-���m����уW�k�N���I�`�h |
|
|
�X��RN�A�[�[A |
��{������ѓ�{��RNA |
3�f���[�Ƀs���~�W���k�N���I�`�h������5�f-OH�3�f-p�I���S�k�N���I�`�h |
|
|
RN�A�[�[T1 |
��{������ѓ�{��RNA |
3�f���[�ɃO�A�j���k�N���I�`�h������5�f-OH�3�f-p�I���S�k�N���I�`�h |
|
|
RN�A�[�[U2 |
��{������ѓ�{��RNA |
3�f-���[�Ƀv�����k�N���I�`�h������5�f-OH�3�f-p�I���S�k�N���I�`�h |
|
|
RN�A�[�[T2 |
��{������ѓ�{��RNA |
3�f-���m�k�N���I�`�h |
|
|
�����y�f |
��{��DNA |
||
|
�G �L �\ �k �N �� �A �T �[ |
�w�r�Ńz�X�z�W�G�X�e���[�[ |
��{����DNA,RNA |
3�f-���[���番������5�f-���m�k�N���I�`�h |
|
�B���z�X�z�W�G�X�e���[�[ |
��{����DNA,RNA |
5�f-���[���番������3�f-���m�k�N���I�`�h |
|
|
�咰�ۃG�L�\�k�N���A�[�[�T |
��{����DNA |
3�f-���[���番������5�f-���m�k�N���I�`�h |
|
|
�咰�ۃG�L�\�k�N���A�[�[�U |
��{����DNA |
3�f���[���番������5�f���m�k�N���I�`�h���������A��{��DNA���c�� |
�@��`�q�̑g��������������̂���1�g�̈�`�q�Q�A�܂��͑������̂Ȃ���`�q�̊Ԃŏ抷�����N����A�V�����g�ݍ��킹�̈�`�q�Q���邱�ƁB�����Ǔ���DNA���K�[�[�̍�p�ɂ��O����DNA�z����t�@�[�W��v���X�~�h�Ȃǂ̃x�N�^�[���q��g�ݍ���DNA�W�{��������B�O��DNA�z��̓x�N�^�[�̏�������ēK���ȍזE�ɓ������ꂳ��Ƀ^���p�N���Ƃ��Ĕ��������B
�@�x�N�^�[����h��זE�̒��ŕ����\��DNA���q�ŁA�O��DNA�z��̉^���̖̂������ʂ����B���ȕ����\�͂̂���v���X�~�h�A�t�@�[�W�A�E�C���X�AYAC�����ǂ��č����BDNA�����F�̂ɑg�ݍ��܂��Ɛ��F�̂��̂��̂��x�N�^�[�ƂȂ�B�x�N�^�[�̏����́A�@�זE���ŕ������A���זE�Ɉ��肵�ĕ��z����A�A�����y�f���ʂ������A�B���̑��݂�N���[�j���O�̐��ۂ����j�^�[�ł���I���}�[�J�[�������Ƃ����A���̑��C�זE����e�Ղɉ���ł���Ƃ������Ƃ��悢�x�N�^�[�̏����ł���B
�@�N���[�j���O����N���[���邱�ƁB�@�זE�̏ꍇ��1�̍זE�ɗR������ψ�ȍזE�W�c�邱�Ƃ������B�A��`�q�̏ꍇ�́A�����DNA�z������邱�Ƃ������B���ꂪcDNA�̏ꍇ��cDNA�N���[�j���O�ƌĂԁB��`�q�̃N���[�j���O�́A�x�N�^�[�ɑg�ݍ���DNA�f�Ђ��h��ۂɓ������A�ړI�Ƃ���DNA�f�Ђ��܂ރR���j�[���邢�̓v���[�N�̕����ɂ��B
�@��`�Í����mRNA�̉���z��ƃ^���p�N���̃A�~�m�_�z��̑Ή��W����`�Í��Ƃ����A�R�h���ƌĂ��mRNA��̘A�������O�̃k�N���I�`�h(�g���v���b�g)����̃A�~�m�_���K�肷��B�S����邢�̉���ɉ\��64�̃R�h���̂���61�̓A�~�m�_�ɑΉ�����R�h���Ŏc���3�͑Ή�����A�~�m�_���Ȃ��A�^���p�N���������I�~����R�h���ł���B���`�I�j���ƃg���v�g�t�@���͂��ꂼ��1�����R�h�����Ȃ�������ȊO�̃A�~�m�_�ɑΉ�����R�h���͏k�d���Ă��āA�������݂����`�R�h���Ƃ����B�^���p�N�������͒ʏ탁�`�I�j���̃R�h��AUG(�܂��GUG)����n�܂肶���̃R�h���ɑΉ�����A�~�m�_���y�v�`�h�����ŏ����������邱�Ƃɂ��i�s����B�R�h����5���f3�f�̕�����3�������ēǂ܂�A����d�����ēǂ܂ꂽ��R�h���Ԃɗ]���ȉ�����݂��邱�Ƃ͂Ȃ��B
�@�@�@��`���\
|
�t |
�b |
�` |
�f |
|
|
�t |
UUU�@Phe UUC�@Phe UUA�@Leu UUG�@Leu |
UCU�@Ser UCC�@Ser UCA�@Ser UCG�@Ser |
UAU�@Tyr UAC�@Tyr UAA�@�I�~ UAG�@�I�~ |
UGU�@Cys UGC�@Cys UGA�@�I�~ UGG�@Trp |
|
�b |
CUU�@Leu CUC�@Leu CUA�@Leu CUG�@Leu |
CCU�@Pro CCC�@Pro CCA�@Pro CCG�@Pro |
CAU�@His CAC�@His CAA�@Gln CAG�@Gln |
CGU�@Arg CGC�@Arg CGA�@Arg CGG�@Arg |
|
�` |
AUU�@Ile AUC�@Ile AUA�@Ile AUG�@Met |
ACU�@Thr ACC�@Thr ACA�@Thr ACG�@Thr |
AAU�@Asn AAC�@Asn AAA�@Lys AAG�@Lys |
AGU�@Ser AGC�@Ser AGA�@Arg AGG�@Arg |
|
�f
�f |
GUU�@Val GUC�@Val GUA�@Val GUG�@Val |
GCU�@Ala GCC�@Ala GCA�@Ala GCG�@Ala |
GAU�@Asp GAC�@Asp GAA�@Glu GAG�@Glu |
GGU�@Gly GGC�@Gly GGA�@Gly GGG�@Gly |
�q�X�g������^�j�זE�̊j���ɍL�����݂��ADNA�ƃC�I�����������Ă��鉖��^���p�N���BDNA�̓q�X�g���Ƃ̋K���I�Ȍ����ɂ��܂肽���܂��B���̕����̂̊�{�\���P�ʂ̓k�N���I�\�[���ƌĂ��B�q�X�g���͒ʏ�5��̐���H1�CH2A�CH2�a�CH3�CH4����Ȃ�AH1�ȊO�͏d�ʔ�łقړ��ʑ��݂���B�q�X�g���̓���̃A�~�m�_���ɂ̓��`�����A�A�Z�`�����AADP���{�V�����A�����_���Ȃǂ̑��l�ȏC�����N���邱�Ƃ��m���Ă���A�N���}�`���̍����\���`����A��`�q�������߁A�זE�������߂ȂǂƐ[���ւ���Ă��邱�Ƃ��m���Ă���B
�@�N���}�`��������F���Ƃ������B�^�j�����̊j���ʼn���F�f�ŔZ�����F����镨���B�{���͌��������Ŋj���ɕ��U���đ��݂���\���̂ƒ�`����A������ɂ�����Ïk�����\���̂ł�����F�̂Ƃ��ċ�ʂ���Ă������A���݂ł͐����w�I�ȉ��DNA�Ƃ���q�X�g�����听���Ƃ��A�����Ĕ�q�X�g���^���p�N���ARNA���܂ޕ����̂��w����Ƃ��ėp����B�זE��������ш�`�q�̊������A�s�������ɑΉ����č\���I�ɒ������ω��𐋂���B
3�D �^���p�N���̍����̊J�n�A�����A�I�n�@�\�̐���
���j�����̃^���p�N���̍����̊J�n�ɂ́AmRNA�AN-�z���~�����`�I�j��-tRNAMet�Ƒ召�̃��{�\�[���T�u���j�b�g���J�n�����̂��`������K�v������A���̍�3��̍\�����q(IF1,IF2,IF3)���s���ł���B�͂��߂ɁAIF1,IF2,IF3��30s�T�u���j�b�g�������̂�����A������IF2��GTP�̌����A�����mRNA��N-�z���~�����`�I�j��-��RNAMet�������AIF3���𗣂��A30S�^���p�N�����J�n�̂ƂȂ�B���̂Ƃ�IF2�̖����́AN-�z���~�����`�I�j��-tRNAMet�̔F���ł���AtRNA�������̃A���`�R�h���O���[�v��CAU�z��(�A���`�R�h��)���J�n�R�h��AUG�Ƌt�����ɉ�����`�����āAmRNA�ƌ�������B�܂�tRNA�̃A���`�R�h����mRNA�̃R�h���Ƒ���I�ȉ������邱�ƂőΉ�����A�~�m�_�����m�Ɍ��肳���B30S�^���p�N���������̂�50S�T�u���j�b�g�ƌ������AIF2���Ɋ܂܂��GTP�A�[�[����p���AGTP��GDP�Ɩ��@�����_�ɉ�����������A���̌���IF1��IF2���𗣂���70S�J�n�����̂������A�^���p�N�������̏����������B���̂Ƃ����{�\�[�����tRNA���������镔�ʂ�A����(�A�~�m�A�V������)��P����(�y�v�V�W������)��2�����ŁAN-�z�X�~�����`�I�j��-tRNAMet��P���ʂɁA���̃R�h���ɑΉ�����A�~�m�A�V��tRNA��A���ʂɂ���B���̂悤�Ƀ^���p�N���̍����J�n�ɂ͊J�n�����̂̌`�����K�v�ł���B
�^�j�����̖|��J�n�͊�{�I�Ɍ��j�����Ɠ�����A���ʁAP���ʂȂǂ̖������ς��Ȃ��B��������蕡�G��10��̊J�n���q�i�^�j�J�n���q�AeIF�j���K�v�ł���B�͂��߂�Met-tRNAMet�eIF��GTP�Ƃ�����������A40S�T�u���j�b�g�ƌ������A����ɃL���b�v�\���^���p�N�ƌ�������mRNA�ƊJ�n�����̂��`������B���̍ە����̂��܂Ƃ߂邽�߂�eIF�R�ƊJ�n�R�h����AUG��T�����߂̋쓮�G���W���Ƃ��ē����S���eIF���K�v�ł���B�܂����̒i�K�Ō��j�����ł͌����Ȃ�ATP�̉����������s����B����eIF2�ƌ�������GTP��eIF5�������������邱�Ƃ���������60S�T�u���j�b�g�������A80S�^���p�N���������̂������B�^���p�N���������J�n����B�����̌`����A�𗣂����J�n���q�͎��̊J�n�����̌`���ɗp�����A1�{��mRNA�ɂ͊���̃��{�\�[�������̂��`������A�|���\�[�����`������B
�y�v�`�h���̉����ł́A�A�~�m�_��1����N���[����C���[�̕����ɂȂ���B���̃^���p�N���������q(EF)���֗^���AGTP�̉�������������ɋ�������B�����T�C�N���ɂ́AmRNA�̎��̃R�h�����w�肷��A�~�m�_�����������A�~�m�A�V��-tRNA��A���ʂɂ����ƂŎn�܂�B�q�h����UGG(�g���v�g�t�@���R�h��)�Ȃ��Trp-tRNA��EFTu�GTP�����̂ƌ������āAtRNA�EFTu�GTP�����̂�����A���ꂪ70S���{�\�[����A���ʂɌ�������B�����EFTu��GTP�A�[�[��p�ɂ��GTP��������������AEFTu�ƂƂ��Ƀ��{�\�[�����痣���B�����Ń��{�\�[�����g�̂��y�v�`�W���g�����X�t�@�[�[��p�������AP���ʂ�fMet-tRNA��N-�z���~�����`�I�j���c�A���ʂ�Trp-tRNA�ƃy�v�`�h�������`�����AfMet-Trp-tRNA����B�������ăy�v�`�h���́AtRNA�ɏ�����܂�N���[����C���[�̕����ɍ�������Ă����B
N-�z���~�����`�I�j������͂�����tRNA�����{�\�[������͂������߂̃G�l���M�[�́A�������qEFG��GTP�����{�\�[���Ɍ������AEFG��GTP�A�[�[�̍�p��GTP��GDP�ɕ������ċ�������B����ƂƂ���A���ʂō������ꂽ����̃y�v�`�W��-tRNA��P���ʂɈڂ�A������mRNA���P�R�h���������ʒu�������B���̒i�K���g�����X���P�[�V�����Ƃ����B��������1�T�C�N�������B���͋�A���ʂɂ��̎��̃R�h���ɂ���Ďw�肳�ꂽ�A�~�m�A�V��-��RNA���t���AP���ʂ̃y�v�`�W��-tRNA����y�v�`�h������āA�y�v�`�h���̉������J��Ԃ��B����mRNA�ł͑����̃��{�\�[�������ă|���\�[�����`�����A�����ɉ��{���̃y�v�`�h���̍������N�����B�y�v�`�h������1�`������̂ɁA���G�l���M�[�����_������4��������B
�^�j�����T�C�N���́A���j�����T�C�N���Ǝ��������ŁAeEF1��EFTu��EFTs�̋@�\�������AeEF2��EFG�̑���ɓ����B
�y�v�`�h�I�~�\�����mRNA�̃R�h����UAG,UAA,UGA�̏ꏊ�ɂ���Ƃ����̃R�h���A�~�m�_���Ή������A�Ή�����A�~�m�V��-tRNA�����݂��Ȃ��B����ƏI�����q(���j�זE�ł�RF1��RF2)�������ăy�v�`�h��tRNA�̊Ԃ̌������ؒf����A�y�v�`�h�����{�\�[������V������BRF1��UAG,UAA�ɁARF2��UGA,UAA�ɓ����B�V�������y�v�`�h���̃z���~������͂����^���p�N��������������B�^�j�����ł�eRF���S�I�~�R�h����F������B
![]()