<実験6>光合成色素の分離と蛍光の観察
実験6−1 クロマトグラフィーによる光合成色素の分離
【目的】*光合成のメカニズムについて理解する。
*光合成色素の種類と役割(吸収スペクトル)を理解する。
*植物色素と動物色素の違い(種類と役割について)を理解する。
【方法】
※青ジソ、赤シソ、ユーグレナ、海草などから、赤シソを材料として選んだ。
1.葉など(5〜10g程度)をはさみで細かく切り、シリカゲル(薬匙一杯)と一緒に乳鉢・乳棒ですり潰す。シリカゲルによって脱水されてパウダー状になる。それを薬包紙にとり、15mlのチューブにうつす。
2.抽出液8ml(ファルコンチューブの目盛で)を加えて攪拌・抽出する。
3.ロート状にした4折ろ紙をビーカーに入れ、2.の抽出液を濾過する。
4.ペークロ用濾紙上の原点(必ず展開溶媒より少し上)に鉛筆で印をつける。抽出濾液をパスツールピペットで取り、着点する(息を吹きかけながら乾かすとよい)。
5.(ゴム栓の切れ目に濾紙をはさみ)展開液の入った試験管にセットして20分展開。
6.展開後ゴム栓をはずして、中のペーパーを取り出し、すぐに溶媒前線(展開液が進んだところ)に鉛筆で線を引く。また各スポットのまわりに鉛筆で印をつける。
7.各スポットの中心までの距離を溶媒前線までの距離で割った値(Rf値)を求める。Rf値は、条件が同じであれば色素の種類により一定の値を示す。
【結果】
【考察・結論】
Rf値や、色素の色などから、分離された色素は上から順にカロテン、クロロフィルa、クロロフィルb、アンテラキサンチン、ビオラキサンチンであると考えられる。Rf値が高いということはそれだけ有機溶媒に溶けやすいことを示している。このことから、カロテンが一番溶けやすく、キサントフィル類のビオラキサンチンが一番溶けにくいということがいえる。原点に残っていた赤っぽい色素はアントシアニンである。これはアントシアニンが有機溶媒には溶けないという性質を持っているためである。
※TLC(薄層クロマトグラフィー)とは、ガラス、プラスチック、アルミニウムの板上に、シリカゲルやアルミナ、セルロースなどの吸着剤を薄膜状に固定した薄層プレートを用いるクロマトグラフィーであり、通常,薄層クロマトグラフィー(Thin Layer Chromatography, 省略して TLC )と呼ばれる。薄層プレートの一端を溶媒に浸すと、吸着剤の間隙を毛細管現象により溶媒が移動する。薄層プレート上に試料物質が存在すると、溶媒の移動にともない試料も移動する(これを展開するという)。このとき、試料の固定層の吸着剤への吸着の強さと移動層の溶媒への溶解性の違いにより、試料の移動する様子(距離)が異なる。この違いを利用することにより、有機化合物の分離、同定を行う。
この分析法は、吸着クロマトグラフィーの一種であり、カラムクロマトグラフィー、ガスクロマトグラフィー、高速液体クロマトグラフィーなどと原理は同じである。薄層クロマトグラフィーは、他の吸着クロマトグラフィーに比べて、操作に必要な時間が短く簡便であるという利点がある。したがって、有機合成反応の進行状況の追跡や化合物の純度を調べるためによく利用される。
*光合成のメカニズム
光合成 (photosynthesis) は,高等植物や緑藻(青色細菌)が葉緑体(クロロプラスト)内で行う,二酸化炭素の固定反応である。この過程で水が酸素に酸化され,二酸化炭素は還元されて糖になる。年間に約1011t もの炭素が光合成で固定される。
CO2 + H2O → [CH2O] + O2
光合成は大きく2つの段階に区別される。1つは明反応と呼ばれ,光のエネルギーを利用して水が酸素に酸化されるとともに,二酸化炭素の還元に必要なNADPH2+とATPをつくりだす。もう1つの段階は暗反応と呼ばれ,NADPH2+とATPを利用して二酸化炭素から種々の糖がつくられる。
植物の光合成の最初の段階は,光のエネルギーを利用し,水を酸化して酸素にすると共に,暗反応の二酸化炭素還元に必要なNADPH2+とATPをつくりだすことである。これらの過程を明反応(light reaction)といい,全行程は
2 H2O + NADP+ → 2 NADPH2+ + O2
ADP + Pi → ATP
となる。光合成で発生する酸素(O2)はこのように水に由来する事が分かる。
光合成が行われる葉緑体(chloroplast)には透過性の良い外部境界膜と,透過性の低い内部境界膜がある。クロロプラストの内部はストロマと呼ばれる。ストロマには高濃度の酵素があり,その半分はリブロースビスリン酸カルボキシラーゼ
(Rubisco) である。また,ミトコンドリアと同様に,二本鎖の環状DNAや原核細胞型のリボソームが存在する。DNAは約100種のタンパク質をコードしているが,それでも葉緑体で必要な約10%にしか過ぎない。
ストロマ内には膜で包まれたチラコイドという構造物が存在する。チラコイドが10〜100個積み重なり,グラナという構造をとっている。グラナ間はストロマラメラで連結されている。
チラコイド膜はリン脂質の含量が約10%と低く,ガラクトースを含む糖脂質(下図)が大部分を占める(80%)。また,脂肪酸は不飽和度が高いため,膜の流動性が高い。
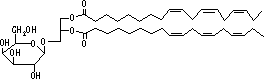
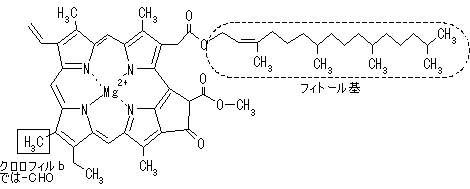
光を受容する受容体は,クロロフィル(Chl) a, bという緑色の色素である。クロロフィルはプロトポルフィリンIXの誘導体で,中心にMg2+が配位している。Mg2+が配位していないものをフェオフィチンという。
|
[クロロフィル a (Chl a)の構造] クロロフィルはプロトポルフィリン IXの誘導体で,中心にMg2+が配位している。クロロプラスト中の大部分のクロロフィルは光を集めるアンテナの役割を果たす。吸収された光子のエネルギーはアンテナクロロフィル間を励起エネルギーとして移動し,アンテナクロロフィルよりも励起エネルギーの低い反応中心クロロフィルに集められる。クロロフィルが吸収できない波長の光を集めるために,カロテノイド(橙色),フィコエリトロビリン(赤色),フィコシアノビリン(青色)など,別の色の色素も使われる。
[フェオフィチンa (Pheo a)の構造] クロロフィルaのMg2+が2H+に置換された分子をフェオフィチンaという。 |
クロロプラスト中の大部分のクロロフィルは光を集めるアンテナの役割を果たす。吸収された光子のエネルギーはアンテナクロロフィル間を励起エネルギーとして移動し,アンテナクロロフィルよりも励起エネルギーの低い反応中心クロロフィルに集められる。反応中心クロロフィルは,タンパク質,電子伝達補因子,クロロフィル二量体(特別ペア, special pair)からなる複合体である。
明反応において,光のエネルギーを利用してATPとNADPH2+を合成した。これらを用いて,二酸化炭素から糖を合成する過程を暗反応(dark reaction),Calvin サイクル,または還元的ペントースリン酸回路という。暗反応では光のエネルギーを一切必要としない。
3 CO2 + 9 ATP + 6 NADPH2+→ GAP + 9 ADP + 8
Pi + 6 NADP+
これはまさに,二酸化炭素を還元して糖(GAP)を創り出したことに他ならない。
*光合成色素の種類とその役割
光合成色素は光合成に必要な光エネルギーを捕捉する生体色素で、クロロフィル(クロロフィルa,b,c,バクテリオクロロフィルa,b,c,d,e,f,g)、カロテノイド(β−カロテン、ルテイン、ビオラキサンチン、スピリロキサンチン、スフェロイデン)、フィコビリン(フィコシアノビリン、フィコエリトロビン)の三種類がある。
このように植物が多くの光合成色素をもっている理由は補助アンテナとして働くためである。もっとも一般的な色素である葉緑素(クロロフィル)が吸収できない光、つまり緑色の光を吸収する色素を持てば、太陽の光のいろいろな色の光(虹の7色)をより有効に使うことができる。シアノバクテリアという単細胞の光合成生物では、クロロフィルの他にフィコビリンという色素を持っているが、これはクロロフィルが吸収できない光を有効に利用するための仕組みである。クロロフィルにはクロロフィルa、クロロフィルb、クロロフィルcといった少しずつ吸収する光の色(波長)が違うものがあるが、これらも、少しでも広い範囲の色の光を吸収するための仕組みと考えることができる。
もう一つの場合は、安全装置として働く場合である。植物の葉にはβーカロチンという黄色い色素が含まれているが、これはアンテナとしての働きは弱く、むしろ光が強すぎた場合に、余分な光によって生じた体に害を及ぼす物質(活性酸素といいます)を無害にする働きをしている。植物には他にもキサントフィルという一群の色素が含まれていますが、これらも一種の安全装置として働いていると考えられている。
*植物色素と動物色素の違い
植物の色素は主に光合成のためにある光合成色素である。
動物の色素は体色の原因となるもので、黒色素胞のメラニン、黄(赤)色素胞のプテリンおよびカロテノイド、虹色素胞のプリンの三種に大別される。
【参考文献】
http://www.chem.tottori-u.ac.jp/~konishi/xmorik/tlc.html
http://133.100.212.50/~bc1/Biochem/Photosyn.htm
http://www.biol.s.u-tokyo.ac.jp/users/sonoike/shikiso.htm#4
実験6−2 蛍光観察
光合成色素は光エネルギーを捕まえることができる。光エネルギーを捕まえたクロロフィルは、電子を励起状態にして、そのエネルギーを電子伝達系に渡してATPとNADPHを合成する。しかし、抽出した光合成色素では励起した電子を渡す相手がいないので、エネルギーを蛍光として放出して基底状態に戻る。その蛍光を観察する。
【目的】*光合成色素が光エネルギーを捕まえて行う光合成の明反応について理解する。
*ATPとNADPHについて理解する。
*光リン酸化機構について考える。
【方法】
1.実験6−1の4.で残った濾液(色素抽出液)を使う。原液もしくは希釈液を使用する。希釈は1/10(500μl抽出液を5mlに希釈)、1/100(50μl抽出液を5mlに希釈)、1/1000(5μl抽出液を5mlに希釈)にする。
2.色素液に、スライドプロジェクター(懐中電灯などでも可)で光を照射する。見る角度によって見え方が異なるので、いろいろな角度から見る。
3.カラーフィルターで照射する光の波長を変えると、蛍光の強さが変わる。フィルターの色と蛍光の強弱の関係を観察して吸収スペクトルについて観察する。
4.分光光度計の波長350nm〜800nmまで50nmづつ変化させたときの吸光値を求める。
【結果】
蛍光観察では懐中電灯の光が当たった部分だけが、赤い色になった。
|
波長 |
350 |
400 |
450 |
500 |
550 |
600 |
650 |
700 |
750 |
800 |
|
吸高値 |
2 |
2 |
2 |
0.85 |
0.58 |
0.61 |
1.01 |
0.02 |
0 |
0 |
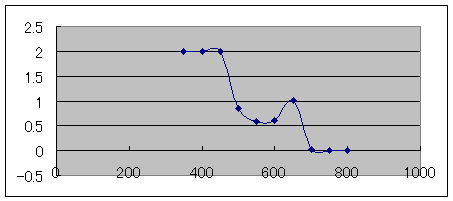
分光光度計の表、グラフは上のようになった。
【考察・結論】
クロロフィル抽出液が赤色に見えるのは、クロロフィルが吸収した光エネルギーをより波長の長い光(赤)として放出したために生じるものである。
分光光度計で測定した吸光値は波長が350nmから450nmで大きく、550nm付近で小さくなり、650nm付近でまた大きくなり、700nm以上だとほとんど0になった。このような結果から、クロロフィルaに近い反応を示している。そのため、この色素は多くクロロフィルaが含まれていると考えられる。
*明反応
光合成の機能単位は,光化学系(Photosystem, PS)と呼ばれるタンパク質とクロロフィル(Chl)や補助色素の複合体である。光化学系は2つあり,光化学系(Photosystem, PS)I,IIと呼ばれる(番号は発見順)。
これらはチラコイド膜に埋め込まれている。
光化学系I (PS I)の反応中心クロロフィル(特別ペア)の吸収極大は700 nmで,この2つはP700と呼ばれる。一方,光化学系II (PS II)の吸収極大は680 nmで,特別ペアはP680と呼ばれる。さらに,タンパク質と結合した色素分子で構成される集光性複合体(light harvesting complex,
LHC)がある。LHCは光化学系の構成員ではなく,一部はPSIと,他はPSIIと結合している。また,両方に結合できる可動性のものもある。
明反応は,PSIIが光のエネルギーを受け取って酸素発生複合体(OEC)を活性化させることで開始される。水の分解で生じた電子は,以後,ミトコンドリアの呼吸鎖で見られる電子伝達系と同様に,タンパク質や色素間でやり取りされる。
*ATPとNADPHについて
ATPとはアデノシン3リン酸(Adenosine triphosphate)の略で、生物の細胞中に必ず存在する、すべての生命活動をつかさどる重要な化学物質。
NADPHとは還元物質である。
*光リン酸化機構
光化学系IIにおける水2分子の酸化で4H+,シトクロムb6-f複合体で8H+,合計12H+がストロマからチラコイド内に生成または取り込まれる。この結果,チラコイド膜を挟んでプロトン勾配が生じることとなる。
このプロトン濃度勾配(pH勾配)を解消するために,ミトコンドリアにおける酸化的リン酸化の場合と同様,プロトンがATP合成酵素(H+輸送ATPase)を通ってストロマ側に汲み出される。3H+の移動と共役して,ADPとリン酸から1分子のATPが合成される。これを光リン酸化(photophosphorylation)という。
ミトコンドリアの場合と異なる点としては,チラコイド膜がMg2+やCl-を通すために電荷的中性は保たれ,ATP合成の駆動力は電荷勾配ではなく,pH勾配だけに依存することである。ストロマとチラコイド内のpHの差は3.5にも達する。
ATP合成酵素の分子的構成はCFoとCF1の2つの部分から成り,それらのサブユニット構成もミトコンドリア酵素と酷似している。ATP合成機構もほぼ同じと推定される。ただし,ATPase複合体の分子の向きは,ミトコンドリアでは内向きであるのに対して,クロロプラストではストロマ側つまり外向きである。
実験6−3
【目的】アントシアニンの性質を知る。構造を調べる。
アントシアニンは細胞小器官のどこにあるかを観察し、クロロフィルとの違いを考える。
【方法】
1.実験6−2で残った濾液を抽出液で4mlまで希釈する。
2.10%食塩水を4ml加え攪拌後放置して、2層に分離させる。
3.下の層を二本のチューブに分け、一方に1%塩酸、もう一方に1%水酸化ナトリウムを少しづつ滴下しながら滴下数と色調の変化を観察する。
【結果】
2層に分かれたとき、上の層は緑色で、下の層は透明だった。塩酸を入れたほうは3滴で透明から薄いピンク色になった。水酸化ナトリウムを入れたほうは10滴でごくうすい黄緑色になった。
クロマトグラフィーではアントシアニンは原点から移動していなかった。
【考察・結論】
上下の層の色の違いから、上の層にはクロロフィル類やカロテノイド類が含まれていたのではないかと考える。
pHによって色が変わったことから、アントシアニンはpHによって色を変えるという性質を持つということが考えられる。
*アントシアニンの構造・性質
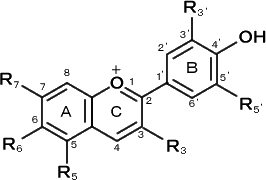
アントシアニンとはアグリコン(右図の基本骨格。アントシアニジンともいう)に糖,有機酸が結合したものをいう。基本的なアグリコンは、3,5,7,4’‐位(R3,R5,R7,R4’のこと)に水酸基をもち、B-環の水酸基(−OH)やメトキシル基(−OCH3)の数により差異が生じている。その差異によって天然から18種類のアントシアニジンが見出されている。通常みられるのはペラルゴニジン,シアニジン,デルフィニジン,そしてメチル化されたペオニジン,ペチュニジン,マルビジンの6種類。これらアグリコンの色調はB‐環の水酸基の数によって変化する。水酸基が多いほど青色(深色)にシフトして紫色になる。また、3‐デオキシ体は赤色(浅色)にシフトして橙色になる。通常アントシアニジンは不安定なため、糖が結合した形(配糖体)で植物中に存在する。(この配糖体をアントシアニンという。)糖は酸素原子を介してアグリコンとグリコシド結合で結合している。通常はβ‐結合の形をとる。 結合糖は1,2,3糖類で、結合位置はアグリコンの3‐位水酸基が最も多く、他に3,5‐;3,7‐;3,3’‐などがある。さらにこの配糖体の糖部に有機酸がエステル結合したもの(アシル化アントシアニンといいます)もある。結合する有機酸には大きく分けて2種類あり、芳香族有機酸と脂肪族有機酸がある。芳香族有機酸にはさらにヒドロキシケイ皮酸類(コーヒー酸,フェルラ酸など)とヒドロキシ安息香酸類(p−ヒドロキシ安息香酸,没食子酸など)がある。脂肪族有機酸にはマロン酸や酢酸,シュウ酸,コハク酸,リンゴ酸などがある。アシル化したアントシアニンは(有機酸の種類,結合数によってその程度に差異はあるが)安定性が高くなる。
アントシアニンの特徴としてpHの変動による色調の変化があげられる。酸性が強くなるほど明るくなり、中性〜アルカリ性へと移行するほど暗くなっていく。同時に、安定性もpHによって変化し、酸性が強いほど安定で、中性,アルカリ性になる程不安定になる。この変化は、左図C環における脱プロトン化、同C環2位炭素における水和によるもの。アントシアニンの種類によって色調,安定性は一様ではなくそれぞれ異なる。これはアントシアニンの構造において"R"に結合する物質の数や種類の違いによって左右されるからである。例えば、赤キャベツでは酸性が強いほど赤、中性へかけて赤紫〜紫となり、赤ダイコンでは酸性が強いほど橙色、中性へかけては橙〜赤となる。安定性は赤キャベツの方が優れている。