核酸
五炭糖
b-D-リボース
・・・RNAにのみ存在
2-デオキシ-
b-D-リボース
・・・DNAにのみ存在
リン酸
H3PO4
D-リボース デオキシ-D-リボース
塩基
(base)
プリン系
・・・アデニン、グアニン
ピリミジン系
・・・シトシン、ウラシル(RNAのみ)、チミン(DNAのみ)
<実験7>遺伝子DNAの実験
【要点】*細胞の情報源であるDNAの性質を知る。
*DNAの構造と機能を考える。
実験7−1 DNAの抽出と精製
【目的】DNAの性質を知る。DNAを抽出、精製する。
【方法】
湯銭の準備をする。
鮭の白子12.5g、1%SDS150ml、氷50gをミキサーに入れて数分ホモジナイズしたものを各班に20〜30ml程度ずつ配られた。
1.2mol/lの塩化ナトリウムを20ml加えて軽く混ぜる。
2.100℃で5分湯煎する(DNAは壊れやすい状態であるので優しく扱う)。
3.温度が下がったら、4枚重ねのガーゼで搾らないように濾過する。
4.氷上で溶液の2〜3倍容量の冷エタノールを静かに加える。
5.スパーテルで静かにかき混ぜ、繊維状になったDNAを巻き取る。
6.スパーテルで巻き取ったDNAをつり上げ、空気中でエタノールを気化させる。エタノールをよく取り除く。(アルコールがあると溶けない)
7.得られたDNAを3mlの蒸留水に溶かす。
【結果】
半透明なDNAが得られた。
【問】
1.について−塩化ナトリウムの終濃度は2mol/l×0.02l×0.5=0.02mol/l
2.について−湯煎することによって、DNAの液が白色から半透明になり、水っぽくなった。
【考察・結論】
細胞中にはDNAが存在している。DNAの色は無色に近い。
1.で塩化ナトリウムを加え、2.で加熱したのは、細胞に含まれる余分なもの、すなわちタンパク質を取り除くためである。タンパク質は分子コロイドであるため、多量の電解質で塩析して沈殿する。そしてタンパク質は熱に弱く、DNAは熱に強い性質を持つ。これらのDNAとタンパク質の化学的な性質の違いを利用してDNAだけを抽出した。
*DNAの性質・構造・機能
細胞の中にあるDNAには、遺伝のもととなる情報、つまり「生命の設計図」が書き込まれていて、親と同じ性質を子へ、子から孫へと伝えていく役割をしている。DNAのもつ遺伝情報には、大きく分けて3つの情報がある。
(1)生物の形や働きに必要な全種類のタンパク質の構造 (アミノ酸の配列)を指定する情報。
(2)どのタンパク質(種類)をいつ(時間)、どこで(部位)、どれだけ(量)つくるかという情報。
(3)DNA自体を複製するための情報。
DNAはこれらの遺伝情報をもとにして、タンパク質を作り、親と同じ性質をもった子のDNAをつくっている。
DNAは細胞の核や核様体に存在するが、ミトコンドリアや葉緑体にも少量のDNAがある。
遺伝情報を担うゲノムの実体である。
DNAの1次構造: 塩基の配列順序のことで,遺伝情報そのものである。遺伝子部分はタンパク質やRNAの1次構造を指定する。
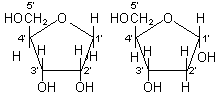
DNAの2次構造: RNAと異なり,DNAは二重らせん構造(double helix)をとる。二重らせん構造には通常のB型DNA以外に,立体構造が少しずつ異なるA型DNAやZ型DNAもある。これらは互いに主溝(major groove)や副溝(minor groove)の深さが異なる。核酸は次のように五炭糖、リン酸および塩基から成る。五炭糖にはD-リボースとデオキシ-D-リボースの2種があり、リボ核酸(RNA)にはD-リボース、デオキシリボ核酸(DNA)にはデオキシ-D-リボースが含まれる。塩基はアデニン(A)、グアニン(G)、シトシン(C)、ウラシル(U)、チミン(T)の5つがあるが、RNAではA, G, C, U、DNAではA, G, C, Tが含まれる。核酸(DNAやRNA)は、ヌクレオチド単位が長く連結した鎖状の高分子化合物である。
|
核酸 |
五炭糖 |
b-D-リボース |
・・・RNAにのみ存在 |
|
|
2-デオキシ- |
・・・DNAにのみ存在 |
|||
|
リン酸 |
H3PO4 |
D-リボース デオキシ-D-リボース |
||
|
塩基 |
プリン系 |
・・・アデニン、グアニン |
||
|
ピリミジン系 |
・・・シトシン、ウラシル(RNAのみ)、チミン(DNAのみ) |
|||
◎アルカリに対する安定性 :RNAは酸化され易い2'-OH基があるため,希アルカリで分解される。DNAはアルカリに安定。この性質はDNA中の微量のRNAを除去するのに利用される。
◎加水分解酵素 :RNAやDNAを加水分解する酵素が数多く存在し、それぞれを分解・除去するのに広く利用される。酵素の作用点にはa型とb型の2つがある。
【参考文献】
http://133.100.212.50/~bc1/Biochem/NAs.htm
実験7−2 DNA分解酵素による確認実験
【目的】*DNA分解酵素について学ぶ。
*酵素:DNase,トリプシンについて調べる。
【方法】
1.実験7−1で得られたDNA溶液を3本のエッペンチューブに50μ?ずつ取る。
2.各々に、水、0,1%DNase、0.3%トリプシンを10μ?ずつ加え、軽く混和する。
3.室温で5分間反応させた後、エッペンチューブに10μ?とりわけ、色素を2μ?加えてアガロースゲル電気泳動を行う。(30分程度)
4.泳動後、UV検出器でDNAの断片化を確認する。
5.写真をとる。
【結果】
水、トリプシンを加えたDNA溶液は写真に写っていたが、DNaseを加えたものは写真に写っていなかった。水を加えたものと、トリプンを加えたものでは電気泳動の様子に差は見られなかった。
【考察・結論】
DNaseだけ写真に写らなかったのは、DNaseによってDNAが分解されてしまい、写らなかったと考えられる。このことから、DNaseはDNAを分解する酵素だといえる。トリプシンはタンパク質分解酵素なので、DNAは分解されなかった。これは酵素の基質特異性によるものである。
※核酸はリン酸基に起因する負の電荷をもつので、常に陽極に移動する。この時、短い断片ほど速く移動する。
*DNA分解酵素(DNase)
ヌクレアーゼ(nuclease)はDNAやRNAを処理するために利用される。RNAを分解するものをリボヌクレアーゼ(RNase)、DNAを分解するものをデオキシリボヌクレアーゼ(DNase)という。
5'または3'末端から順にヌクレオチドをはずしていく酵素をエキソヌクレアーゼ(exonuclease)、ヌクレオチド鎖の途中を切断する酵素をエンドヌクレアーゼ(endonuclease)という。ヌクレアーゼはホスホジエステル結合のどちら側を分解するかで、次の2つがある。
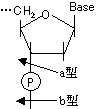
DNaseの場合、一本鎖を切断する酵素と、二本鎖を切断する酵素がある。
|
名称 |
起源 |
特異性 |
被切断鎖 |
切断様式 |
|
膵臓RNase |
ウシ |
RNA |
一本鎖 |
エンド(b型) |
*トリプシンについて
トリプシンとは、肝臓から小腸内に分泌されるタンパク質分解酵素の一種で、加水分解酵素(セリンプロテアーゼ) のひとつ。プロテアーゼは他の蛋白質を切ることで体の中で多くの重要な機能を果たしている。プロテアーゼには一般に、切られるべき特定のペプチド結合を並べるように他の蛋白質のアミノ酸側鎖を入れ込む深い溝がある。Lys と Arg残基のカルボキシル基側のペプチド結合を切断するタンパク分解酵素である。 もともと膵液中のトリプシノーゲンが十二指腸粘膜から分泌されたエンテロキナーゼによって活性化されたもので あり、トリプシンが他のすべてのチモーゲンを活性化するので、膵酵素活性化の鍵反応となる。
【参考文献】
http://133.100.212.50/~bc1/Biochem/Technic.htm
http://eprots.protein.osaka-u.ac.jp/eProtS/Chain.do?from=group&lang=ja&pdb_id=1TRN
実験7−3 DNAの定量(濃度測定)
【目的】DNAの濃度を測定する。
【方法】
1.エッペンチューブに実験7−1で得られたDNA溶液40μ?とり、1960μ?蒸留水を加えてA???、???を測定する。
2.DNA濃度の決定
【結果】
測定値(A???)0.05 (A???)0.16
DNA濃度:A???×0.05×50=0.125(μg/ml)
タンパク質濃度:A???×0.05×50=0.4(μg/ml)
A???/A???値は、0.3125である。
【考察・結論】
以上の結果から、私たちのグループのDNA溶液は、DNAよりもタンパク質のほうが多く含まれていて、純度がとても低いDNA溶液だったことがわかった。
実験7−1で、巻き取ったDNAがあまり水に解けていなかったことから、エタノールを十分に気化させなかったことが原因ではないかと考える。もっとエタノールを十分に気化させていれば、とれたDNAがたくさん溶けて純度の高いものが得られたと考える。
タンパク質の濃度が高かったのは、実験7−1でうまくタンパク質を取り除くことができなかったためといえる。
※2本鎖DNAでは50μg/ml、また1本鎖DNAでは40μg/mlの濃度のとき、DNA溶液の260nmlにおける吸光度は約1.0である。これらの値に基づいて溶液中に含まれるDNAの濃度を求める。
【反省・質問・意見など】
DNAに関するいろいろな実験をやって、DNA、遺伝についてとても身近なものなのだなと思った。電気泳動などは今までやったことがなかったので、とても興味深かった。
DNAの抽出、精製があまりうまくはいかなかったのがとても残念だ。もっと注意深く実験を行えばよかったと思う。今後は一つ一つの実験過程の意味をもっと考えながら実験しようと思う。
マイクロピペットの使い方にはやく慣れたいと思う。